
【题目】小明因胃部不适去医院检查,医生告之是由于“胃酸过多”引起,建议服用抑酸剂。下列药物可作抑酸剂的是
A. 维生素C B. 阿司匹林
C. 复方氢氧化铝片 D. 葡萄糖口服液
科目:高中化学 来源: 题型:
【题目】现以CO、O2、熔融盐Z(Na2CO3)组成的燃料电池,采用电解法制备N2O5,装置如图所示,其中Y为CO2,下列说法错误的是( )
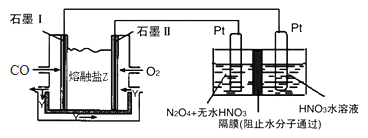
A. 石墨I是原电池的负极,发生氧化反应
B. 若甲池消耗标准状况下的氧气2.24L,则乙池中产生氢气0.05mol
C. 乙池中左端Pt极电极反应式:N2O4-2e-+2HNO3=2N2O5+2H+
D. 甲池中的CO32-向石墨I极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将过量SO2通入下列溶液中,能出现白色浑浊的是
①Ca(OH)2;②BaCl2;③NaHCO3;④Na2CO3;⑤Ba(NO3)2
A. ①②④ B. ②③ C. ④⑤ D. ⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关镁的叙述正确的是( )
A. 工业制造的镁蒸气通常在H2或N2中冷却
B. 镁条燃烧引发的火灾可用CO2来扑灭
C. 镁在空气中燃烧的产物并不全是MgO
D. 镁制容器可用来贮存和运输浓硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以黄铜矿(主要成分二硫化亚铁铜CuFeS2为原料,用Fe2(SO4)3溶液作浸取剂提取铜,总反应的离子方程式是:CuFeS2+4Fe3+=Cu2++5Fe2++2S
(1)上述总反应的原理如图1所示。正极的电极反应式是_______________________________。
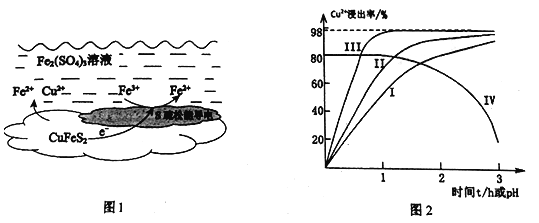
(2)一定温度下,控制浸取剂pH=1,总体积为1L,取三份相同质量黄铜矿粉末分别进行实验,结果如图2:
实验 | 操作 |
I | 加入足量0.100 molL-1Fe2(SO4)3溶液 |
II | 加入足量0.100 molL-1Fe2(SO4)3溶液,通入空气 |
Ⅲ | 加入足量0.100 molL-1Fe2(SO4)3溶液,再加入少量 0.000500 molL-1Ag2SO4溶液 |
①曲线IV是在实验I的基础上改变溶液的pH所得实验结果,请分析pH从2到3,Cu2+浸出率明显下降的原因____________________________(用离子方程式描述)。
②对比实验I、Ⅱ,通入空气,Cu2+浸出率提髙的原因是_________________________。
③由实验Ⅲ推测,在浸取Cu2+过程中Ag+作催化剂,催化原理是:
i . CuFeS2+4Ag+=Fe2++Cu2++2Ag2S
ii.……
写出上述ii的离子方程式_____________________________________________。
为证明该催化原理,进行如下实验:
a.取少量黄铜矿粉末,加入少量0.0005mol·L-lAg2SO4溶液,充分混合后静置。取上层淸液,加入稀盐酸,观察到溶液中_______________________,证明发生反应i
b.取少量Ag2S粉末,加入________________溶液,充分混合后静置。取上层淸液,加入稀盐酸,有白色沉淀,证明发生反应ii
④若实验中样品含铜a mol,则实验I的平衡常数K=_____________(杂质不参与反应,只要求列出计算式,不必算出结果)。
(3)为了进一步研究上述实验Ⅲ结论的可靠性,査得资料Ksp(Ag2S)=6.4×10-50,Ksp(AgCl)=1.8×10-10,试计算,使饱和Ag2S溶液中的Ag+开始转化为AgCl沉淀所需盐酸的最低浓度为____________ mol/L (己知![]() ≈2.5)。
≈2.5)。
查看答案和解析>>
科目:高中化学 来源: 题型:
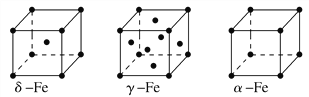
【题目】(1)金属镍及其化合物在合金材料以及催化剂等方面应用广泛。请回答下列问题:
①NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69pm和78pm,则熔点FeO________NiO(填“<”或“>”);
②铁有δ、γ、α三种同素异形体,各晶胞如下图,则δ、α两种晶胞中铁原子的配位数之比为________。
(2)元素金(Au)处于周期表中的第六周期,与Cu同族,一种铜金合金晶体具有立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,则该合金中Cu原子与Au原子数量之比为________;该晶体中,原子之间的强相互作用是________。
(3)某钙钛型复合氧化物如图1所示,以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe等时,这种化合物具有CMR效应。
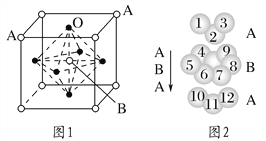
①用A、B、O表示这类特殊晶体的化学式:_________________________。
②已知La为+3价,当被钙等二价元素A替代时,可形成复合钙钛矿化合物La1-xAxMnO3(x<0.1),此时一部分锰转变为+4价。导致材料在某一温度附近有反铁磁-铁磁、铁磁-顺磁及金属-半导体的转变,则La1-xAxMnO3中三价锰与四价锰的物质的量之比为________。
③下列有关说法正确的是________。
A.镧、锰、氧分别位于周期表f、d、p区
B.氧的第一电离能比氮的第一电离能大
C.锰的电负性为1.59,Cr的电负性为1.66,说明锰的金属性比铬强
D.铬的堆积方式与钾相同,则其堆积方式如图2所示
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关钠的叙述中错误的是( )
A. 电解法冶炼金属钠时,钠在阳极析出
B. 钠的化学性质非常活泼,钠元素只能以化合态存在于自然界
C. 钠的还原性很强,可以用来冶炼金属钛、锆、铌等
D. 钠的质地软,可用小刀切割
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在不引入新杂质的情况下,分离FeCl3、KCl、BaSO4的混合物,应选用的一组试剂是
A. 水、氢氧化钾溶液、稀盐酸 B. 水、氢氧化钠溶液、稀盐酸
C. 水、硝酸银溶液、稀硝酸 D. 水、氢氧化钾溶液、稀硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列两种气体的分子数一定相等的是 ( )
A. 质量相等密度不等的NO和C2H6 B. 等体积不等密度的CO和C2H4
C. 等温等体积的O3和N2 D. 等压等体积的N2和CO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com