


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、漂白粉可以在敞口容器中长期存放 |
| B、氯水保存在棕色瓶里并放在冷暗处 |
| C、液氯保存在绿色的干燥钢瓶中 |
| D、溴水盛放在有玻璃塞的细口瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
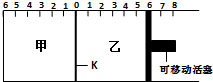 如图所示,甲、乙之间的隔板K可以左右移动,甲中充入2molA和1molB,乙中充入2molC和1molHe,此时K停在0处.在一定条件下发生可逆反应:2A(g)+B(g)?2C(g),反应达到平衡后,恢复到反应发生前的温度.下列有关说法正确的是( )
如图所示,甲、乙之间的隔板K可以左右移动,甲中充入2molA和1molB,乙中充入2molC和1molHe,此时K停在0处.在一定条件下发生可逆反应:2A(g)+B(g)?2C(g),反应达到平衡后,恢复到反应发生前的温度.下列有关说法正确的是( )| A、根据隔板K滑动与否不能判断左右两边的反应是否达到平衡 |
| B、若平衡时K停留在左侧1处,则活塞仍停留在右侧6处 |
| C、到达平衡时,甲容器中C的物质的量等于乙容器中C的物质的量 |
| D、达到平衡后,隔板K最终停留在左侧刻度0--2之间 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、纯碱是重要的化工原料之一,可用于制化学品、清洗剂、洗涤剂 |
| B、氢氧化铝常用于治疗胃病 |
| C、NO可用于某些疾病的治疗;SO2可用于食品防腐剂 |
| D、明矾具有消毒杀菌作用,可用于净水;硫酸钡可用于钡餐透视 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、R2+>X2+>Z2+>Y2+ |
| B、X2+>R2+>Y2+>Z2+ |
| C、Y2+>Z2+>R2+>X2+ |
| D、Z2+>X2+>R2+>Y2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲烷(CH4)在O2中的燃烧反应 |
| B、铝片与稀盐酸反应 |
| C、Ba(OH)2?8H2O与NH4Cl的反应 |
| D、灼热的炭与水蒸气的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、(Ⅰ),① |
| B、(Ⅱ),② |
| C、(Ⅲ),③ |
| D、(Ⅳ),④ |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、该反应的热化学方程式为:N2+3H2?2NH3△H=-92 kJ/mol |
| B、b曲线是加入催化剂时的能量变化曲线 |
| C、加入催化剂,该化学反应的反应热改变 |
| D、升高温度,正、逆反应速率都增大,平衡向逆方向移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com