
����Ŀ����̽�ն�Ա���������ᣬ��С���߽��˻�ѧ�Թ�����֪�����߳�������Ϊ�Թ������ࡰ���˵�Ұ�ޡ������������ᷴӦ�����ʣ����������ܿ����ǣ��������ͨ���� 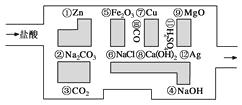
��1������������߳��Թ�������ͼ������ǰ���������������ʾ���ߵ�·�ߣ�����
��2�����ܡ��Ե�������Ļ�ѧ��Ӧ�У�������ͼ��кͷ�Ӧ�������������ܡ��Ե������������ �� д���÷�Ӧ�Ļ�ѧ����ʽ��
��3���ڲ��������ᷴӦ�������У������������������д������ţ���ͬ�������ڵ��ʵ�����
��4����������ỻ���������������������߳���·�ߡ��߳�������Թ���Ϊʲô�� ��
���𰸡�
��1���ۢޢ��??
��2��2��Na2CO3��Na2CO3��2HCl===2NaCl��H2O��CO2��
��3���ۢ⣻��?
��4�����ܣ���Ϊ��������CO�����ʻᱻ���Ե���
����������1��ͼ�����ʢۡ��ޡ��⡢�ߡ������������ᷴӦ���ظ�·�߿��߳��Թ�����2��������NaOH��Ca��OH��2�ķ�Ӧ������ͼ��кͷ�Ӧ���ܡ��Ե������������Na2CO3 �� �÷�Ӧ�Ļ�ѧ����ʽΪNa2CO3��2HCl===CO2����H2O��2NaCl����3���ڲ��������ᷴӦ�������У��������������CO2��CO�����ڵ��ʵ���Cu��Ag����4����������ỻ�����������������������߳���·�ߡ��߳�������Թ�����Ϊ��������һ����̼��ͭ����������ʱ�ᷢ����ӦҲ�ᱻ���Ե�����


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ż�������־���أ�������(���Ĵ�����)��һ�����ݹ���ߣ��������....��ʱ������ľͶ��ȡ��....����Ǿ��ϣ����ε��Ρ��������漰�IJ���������
A.����B.����C.����D.�ᾧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڻ�ѧ����˵����ȷ�ģ� ����
A. ֻ�����ڷ���֮�� B. ֻ����������֮��
C. ����ԭ�Ӽ�ǿ�ҵ������ D. ���ڷ��Ӽ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������������Ҫ�Ļ�ԭ������֪���з�Ӧ���Ȼ�ѧ����ʽ�����й��ڷ�Ӧ���ʱ��ж���ȷ����
2H2(g)+O2(g)===2H2O(g) ��H1
3H2(g)+Fe2O3(s)===2Fe (s)+ 3H2O(g) ��H2
2Fe(s)+ 3/2O2(g)===Fe2O3(s) ��H3
2Al(s)+3/2O2(g)===Al2O3(s) ��H4
2Al(s)+ Fe2O3(s)===Al2O3(s)+2Fe(s) ��H5
A. ��H1<0����H3>0 B. ��H5<0����H4<��H3
C. ��H1=��H2+��H3 D. ��H3=��H4+��H5
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧʽΪAB�����Ӿ��壬��֪5r(A2+)=4r(B2-�����������Ӿ�����![]() ��ϵ����ͼ��ʾ�������ⶨ���ܶ�Ϊ
��ϵ����ͼ��ʾ�������ⶨ���ܶ�Ϊ![]() g��cm-3����Ħ������ΪMg��mol-1���������йظþ����˵����ȷ���ǣ� ��
g��cm-3����Ħ������ΪMg��mol-1���������йظþ����˵����ȷ���ǣ� ��
r+/r- | ��λ�� | ʵ�� |
0.225��0.414 | 4 | ZnS |
0.414��0.732 | 6 | NaCl |
0.732��1.0 | 8 | CsCl |
>1.0 | 12 | CsF |
A���þ���ṹ��ZnS��������
B���þ���ÿ����������2��A2����B2��
C���þ��徧���ı߳�Ϊ cm
cm
D��A2+���ӽ��ڵ�B2-���ɵĿռ�ṹΪ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�ǽ���þ��±�ص���(X2)��Ӧ�������仯ʾ��ͼ������˵����ȷ����

A����MgCl2��ȡMg�Ƿ��ȹ���
B�����ȶ��ԣ�MgI2>MgBr2>MgCl2>MgF2
C�������������ԣ�F2<Cl2<Br2<I2
D����ͼ��֪���¶���MgBr2(s)��Cl2(g)��Ӧ���Ȼ�ѧ����ʽΪ��MgBr2(s)��Cl2(g)===MgCl2(s)��Br2(g)����H����117 kJ��mol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Cl2����������ֱ�ӻ�����ȡ��������
A.AlCl3B.FeCl3C.CuCl2 D.FeCl2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����AgNO3��Na2SO4��BaCl2�������ʰ����ʵ���Ϊ2��1��1�ı�����Ϻ���������ˮ�У�������Һ�д������ڵ������ǣ� ��
A��Ba2+��NO3�� B��Na+��Cl�� C��Na+��NO3�� D��Ag+��SO42��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com