
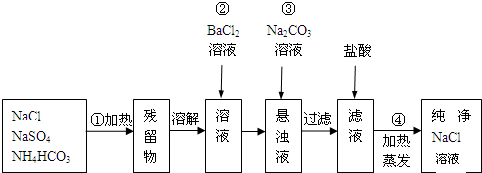


科目:高中化学 来源: 题型:
| A、21.2 g |
| B、21.6 g |
| C、22.0 g |
| D、22.3 g |
查看答案和解析>>
科目:高中化学 来源: 题型:
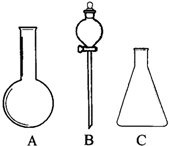 (1)有如图所示A、B、C三种仪器:请选择下列仪器名称的序号,填入相应的空格内:①烧杯②普通漏斗③圆底烧瓶④锥形瓶⑤分液漏斗⑥酸式滴定管
(1)有如图所示A、B、C三种仪器:请选择下列仪器名称的序号,填入相应的空格内:①烧杯②普通漏斗③圆底烧瓶④锥形瓶⑤分液漏斗⑥酸式滴定管查看答案和解析>>
科目:高中化学 来源: 题型:
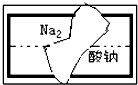 某中学学习小组在帮助老师整理实验室的化学试剂时,发现一盛有白色固体的试剂瓶,标签破损(如图),请你根据已掌握的知识,对该药品可能是什么物质作出猜想(4种),并设计实验验证.
某中学学习小组在帮助老师整理实验室的化学试剂时,发现一盛有白色固体的试剂瓶,标签破损(如图),请你根据已掌握的知识,对该药品可能是什么物质作出猜想(4种),并设计实验验证.查看答案和解析>>
科目:高中化学 来源: 题型:

| I 溶液的体积(mL) | 4 | 8 | 15 | 20 | 50 | 120 | 150 | |
| C的体积(mL) | 0 | 0 | 112 | 224 | 896 | 2240 | 2240 | |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/℃ | 200 | 250 | 300 | 350 |
| 平衡常数K | 9.94 | 5.2 | 1 | 0.5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com