
| 温度/℃ | 200 | 250 | 300 | 350 |
| 平衡常数K | 9.94 | 5.2 | 1 | 0.5 |
| 10-x |
| 10 |
| (1-50%)×2mol |
| 1L |
| 0.5mol |
| 1L |
| 0.5mol |
| 1L |
| c(Z)c(W) |
| c 2(X)c(Y) |
| 0.5×0.5 |
| 12×0.5 |


 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:
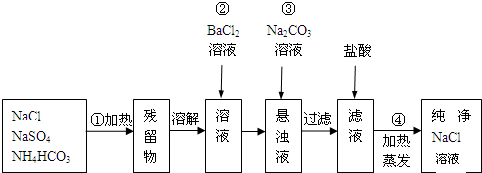
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaAlO2溶液和过量硫酸 |
| B、等物质的量的NaHCO3和Na2O2固体 |
| C、FeSO4溶液和过量溴水 |
| D、溶质的物质的量相同的(NH4)2SO4溶液和BaCl2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在水中的溶解能力大于CuS、CdS、PbS |
| B、在水中的溶解能力小于CuS、CdS、PbS |
| C、在水中的溶解能力与CuS、CdS、PbS相同 |
| D、二者均具有较强的吸附性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用水鉴别乙醇、甲苯和溴苯 |
| B、用燃烧法鉴别乙醇、苯和四氯化碳 |
| C、用碳酸钠溶液鉴别乙醇、乙酸和乙酸乙酯 |
| D、纤维素在人体内可水解为葡萄糖,故可作人类的营养物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、混合物中一定不含有Na2O |
| B、混合物中一定不含有Na2CO3和NaCl |
| C、混合物中肯定含Na2O2、Na2O2和NaHCO3 |
| D、混合物中一定不含有Na2O2和NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子序数A>B |
| B、电子总数A>B |
| C、离子半径A->B2+ |
| D、原子半径A>B |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com