
| A、NaAlO2溶液和过量硫酸 |
| B、等物质的量的NaHCO3和Na2O2固体 |
| C、FeSO4溶液和过量溴水 |
| D、溶质的物质的量相同的(NH4)2SO4溶液和BaCl2溶液 |
| 1 |
| 2 |
| 1 |
| 2 |


科目:高中化学 来源: 题型:
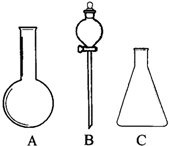 (1)有如图所示A、B、C三种仪器:请选择下列仪器名称的序号,填入相应的空格内:①烧杯②普通漏斗③圆底烧瓶④锥形瓶⑤分液漏斗⑥酸式滴定管
(1)有如图所示A、B、C三种仪器:请选择下列仪器名称的序号,填入相应的空格内:①烧杯②普通漏斗③圆底烧瓶④锥形瓶⑤分液漏斗⑥酸式滴定管查看答案和解析>>
科目:高中化学 来源: 题型:

| I 溶液的体积(mL) | 4 | 8 | 15 | 20 | 50 | 120 | 150 | |
| C的体积(mL) | 0 | 0 | 112 | 224 | 896 | 2240 | 2240 | |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲苯和二氯乙烯分子中所有原子共平面 |
| B、1-丁烯既能发生取代反应,又能发生加成反应,但不能被氧化 |
| C、由甲苯制三硝基甲苯和苯甲酸都属于取代反应 |
| D、分子式为C3H6Cl2的同分异构体有4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、利用电池外壳的金属材料 |
| B、防止电池中汞、镉、铅等重金属离子对土壤和水源的污染 |
| C、回收其中的石墨电极 |
| D、不使电池中渗出的电解液腐蚀其他物品 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/℃ | 200 | 250 | 300 | 350 |
| 平衡常数K | 9.94 | 5.2 | 1 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(NH4+)?c(OH-) |
| c(NH3?H2O) |
| c(NH3?H2O) |
| c(OH-) |
| c(OH-) |
| c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com