
【题目】亚硝酰氯(ClNO)参与大气平流层和对流层的化学,气相的ClNO光解和水解都可产生Cl自由基。
(1)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酰氯,涉及的化
学反应、对应的反应热和平衡常数如表:
化学反应 | 反应热 | 平衡常数 |
①2NO2(g)+NaC1(s) | △H1 | K1 |
②2NO(g)+C12(g) | △H2 | K2 |
③4NO2(g)+2NaC1(s) | △H3 | K3 |
则K1,K2,K3之间的关系为K2=______________,△H3=_____________
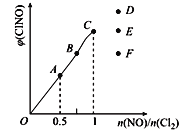
(2)已知2NO(g)+Cl2(g)![]() 2ClNO(g),一定条件下在恒温恒容的密闭容器中按一定比例,充入NO(g)和Cl2(g),平衡时ClNO的体积分数随n(NO)/n(C12)的变化图象如图,则A、B、C三状态中,NO的转化率最大的是___点,当n(NO)/n(C12)=1.5时,达到平衡状态ClNO的体积分数可能是D、E、F三点中的_____点。
2ClNO(g),一定条件下在恒温恒容的密闭容器中按一定比例,充入NO(g)和Cl2(g),平衡时ClNO的体积分数随n(NO)/n(C12)的变化图象如图,则A、B、C三状态中,NO的转化率最大的是___点,当n(NO)/n(C12)=1.5时,达到平衡状态ClNO的体积分数可能是D、E、F三点中的_____点。
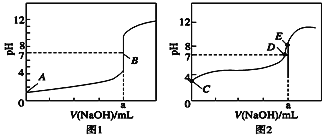
(3)常温下,用0.100 0 mol·L-1 NaOH溶液分别滴定20.00 mL 0.100 0 mol·L-1 HBr溶液和20.00 mL0.100 0 mol·L-1 CH3COOH溶液,得到2条滴定曲线,如图所示:
①根据图1和图2判断,滴定HBr溶液的曲线是______________(填“图1”或“图2”);
②a=______ mL; ③c(Na+)=c(CH3COO-)的点是______点;
④E点对应溶液中离子浓度由大到小的顺序为_______________。
(4) 氨气燃料电池,一极通入氨气,另一极通入空气,电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,它在熔融状态下能传导O2-。写出负极的电极反应式_____________。
(5) 已知:CdCO3、NiCO3溶度积分别为6.0×10-12、1.0×10-7。p(CO32-)=-lg c(CO32-) 。在含Cd2+、Ni2+浓度均为0.01 mol/L的废水中滴加稀碳酸钠溶液。为了分离这两种阳离子,需要控制p(CO32-)范围为_____________(忽略溶液体积的变化)
A.4≤p(CO32-)≤6
B.5<p(CO32-)≤ 7-lg6
C.7-lg6<p(CO32-)≤ 8
D.7<p(CO32-)≤8
【答案】 K12/K3 2△H1-△H2 A D 图1 20.00 D c(Na+)>c(CH3COO-)>c(OH-)>c(H+) 2NH3-6e-+3O2-=N2+3H2O B
【解析】(1)已知:①2NO2(g)+NaCl(s)NaNO3(s)+ClNO(g)
③4NO2(g)+2NaCl(s)2NaNO3(s)+2NO(g)+Cl2(g)
将①×2-③可得:2NO(g)+Cl2(g)2ClNO(g),则平衡常数K2=K12/K3 ;△H2=2△H1-△H3,则△H3=2△H1-△H2,
(2)NO的物质的量越大其转化率越小,所以NO转化率最小的是C点;当反应物的物质的量之比等于其计量数之比时生成物的含量最大,当n(NO)/n(Cl2)=2.8时产物的含量减小,所以应该是F点,NO的物质的量越小其转化率越大;当反应物的物质的量之比等于其计量数之比时生成物的含量最大,为A点;当n(NO)/n(Cl2)=1.5时说较C点NO的物质的量较大,平衡右移,产物的含量增大,为D;
(3)①醋酸为弱电解质,醋酸为弱酸,溴化氢为强电解质,0.1mol/L的HBr溶液的pH=1,而0.1mol/L的醋酸溶液的pH一定大于1,根据图象中氢氧化钠溶液体积为0时溶液的pH可知,滴定HBr溶液的曲线是图1;
②根据图1中溴化氢与氢氧化钠等物质的量时,溶液为中性,则a点时NaOH溶液 的体积为20.00mL;
③根据电荷守恒可知,当c(Na+)=c(CH3COO-)时溶液显中性,即图中D点,此时pH=7,c(Na+)=c(CH3COO-);
④E点时溶液为CH3COONa,溶液显碱性,c(H+)<c(OH-),根据电荷守恒可知,对应溶液中离子浓度由大到小的顺序为c(Na+)>c(CH3COO-)>c(OH-)>c(H+) ;
(4) 该燃料电池中通入氨气的一极为负极,发生氧化反应,电极反应式为 2NH3-6e-+3O2-=N2+3H2O;
(5)Ksp(NiCO3)>Ksp(CdCO3),则最先沉淀的是Cd2+,沉淀完全时溶液中 c(CO32-) =Ksp(CdCO3)÷c(Cd2+)=(6.0×10-12)÷(1.0×10-5)=6.0×10-7mol/L,此时p(CO32-)=-lgc(CO32-) =-lgc(6.0×10-7)=7-lg6;当Ni2+开始沉淀时c(CO32-) =Ksp(NiCO3)÷c(Ni2+)=(1.0×10-7)÷(0.01)=1.0×10-5mol/L,此时p(CO32-)=-lgc(CO32-) =-lgc(1.0×10-5)=5,分离这两种阳离子,需要控制p(CO32-)范围为5<p(CO32-)≤ 7-lg6,答案为B。


科目:高中化学 来源: 题型:
【题目】下列有关物质分类或归类正确的一组是( )
①液氯、干冰、磁性氧化铁均为化合物
②氢氟酸、盐酸、水玻璃均为混合物
③明矾、小苏打、烧碱均为电解质
④牛奶、豆浆、漂粉精均为胶体
⑤Na2O2、Na2CO3、Na2SiO3均为钠盐
A.①② B.②③ C.③④ D.②③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,pH=2的盐酸和醋酸各1 mL分别加水稀释,pH随溶液体积变化的曲线如下图所示。下列说法不正确的是
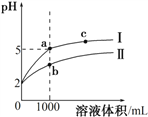
A. 曲线I代表盐酸的稀释过程
B. a溶液的导电性比c溶液的导电性强
C. a溶液中和氢氧化钠的能力强于b溶液
D. 将a、b两溶液加热至30℃,![]() 变小
变小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有X、Y、Z、W、R、Q为前四周期元素,原子序数依次增大。X、Y最外层电子排布可表示为asa,bsbbpb(a≠b),Y、Z、W是位于P区的同一周期的元素,Y与W原子核外的未成对电子数相等,RW2与ZW2-为等电子体,Q为过渡金属元素,其原子核外没有未成对电子。请回答下列问题:
(1)Q的最外层电子排布式为_________ ,RW2的分子立体构型是_________________
(2)Y、Z、W的最简单氢化物中,键角最小的是_______(用分子式表示), YW与Z2互为等电子体,ZW的结构式为____________(若有配位键,请用“→”表示)。
(3)ZX3可以与X+结合成ZX4+,这个过程中发生改变的是____(填序号)。

a.微粒的空间构型 b.Z原子的杂化类型
c.X-Z-X的键角 d.微粒的电子数
(4)QR在荧光体,光导体材料、涂料、颜料等行业中应用广泛。立方QR晶体结构如图所示,一个晶胞中含有的Q原子数为____________。与R原子最近且距离相等的R原子有_____个。该晶胞棱长与最近的两个R原子的距离之比为_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃煤烟气中的SO2、NOx是形成酸雨的有害物质。应设法吸收利用。
I.吸收SO2:通入氨水将其转化为NH4HSO3,NH4HSO3溶液呈_____性(填“酸”、“碱”、“中”);再通空气将NH4HSO3氧化,溶液pH将__________(填“增大”、“减小”、“不变”)
Ⅱ.处理NO:先用O3处理,再用Na2SO3溶液吸收。O3处理的热化学方程式为:
NO(g)+O3(g)=NO2(g)+O2(g) △H=akJ·mol-1
NO2(g)=NO(g)+1/2O2(g) △H=bkJ·mol-1
(1)反应NO(g)+O3(g)=3NO2(g)的△H=_______kJ·mol-1。
(2)用Na2SO3溶液吸收时,溶液中SO32-将NO2转化为NO2-,反应的氧化产物是_________。
Ⅲ.利用SO2:分离出SO2可用于生产硫酸,反应之一:2SO2(g)+O2(g)![]() 2SO3(g) △H<0。
2SO3(g) △H<0。
(3)恒温恒容下,改变SO2、O2的物质的量之比[n(SO2)/n(O2)],平衡时测定Y的值,Y与[n(SO2)/n(O2)]的关系如图所示,则Y可能是______________。
A.正反应速率 B.SO3的体积分数 C.SO2的转化率 D.SO2的体积分数
a→b段y变化的原因是___________。

(4)Kp是以各气体平衡分压(各气体的分压=总压×各气体的体积分数)代替平衡浓度表示的平衡常数。
①Kp与温度(T/K)的关系是㏒Kp=![]() -4.86(R为常数),请判断R___0(填“>”或“<”),原因是________。
-4.86(R为常数),请判断R___0(填“>”或“<”),原因是________。
②在10.0%SO2、13.5%O2、76.5%N2(体积分数)时,SO2平衡转化率与温度、压强的关系如图。

则x_____1.0(填“>”或“<”);计算550℃、1.0atm下,2SO2(g)+O2(g)![]() 2SO3(g)的Kp=____。(精确到1位小数)
2SO3(g)的Kp=____。(精确到1位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中的氯离子浓度与50 mL 1 mol/L的AlCl3溶液中氯离子浓度相等的是
A.150 mL 1 mol/L的NaCl B.75 mL 3 mol/L的NH4Cl
C.150 mL 2 mol/L的KCl D.75 mL 2 mol/L的CaCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】咖啡中的咖啡酸具有抗氧化、抗炎、抗粥样硬化等多种有益作用。其球棍模型如图所示,关于咖啡酸的下列说法正确的是

A. 分子式为C9H10O4
B. 分子中至少有9个碳原子共平面
C. 1 mol咖啡酸与足量NaHCO3反应生1 mol CO2
D. 1 mol咖啡酸最多能够与5 mol H2发生加成反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com