
【题目】在蒸发皿中加热蒸干下列物质的溶液并灼烧,可得原有物质的固体是( )
A.氯化铝
B.碳酸氢钠
C.硫酸铁
D.亚硫酸钠
科目:高中化学 来源: 题型:
【题目】下列物质分离和提纯的方法错误的是( )
A. 用溶解、过滤法分离氯化钾和二氧化锰的固体混合物
B. 用结晶法分离氯酸钾和氯化钠的固体混合物
C. 用加酒精萃取的方法提取溴水中的溴
D. 用蒸馏法分离酒精和水的混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(ClNO)参与大气平流层和对流层的化学,气相的ClNO光解和水解都可产生Cl自由基。
(1)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酰氯,涉及的化
学反应、对应的反应热和平衡常数如表:
化学反应 | 反应热 | 平衡常数 |
①2NO2(g)+NaC1(s) | △H1 | K1 |
②2NO(g)+C12(g) | △H2 | K2 |
③4NO2(g)+2NaC1(s) | △H3 | K3 |
则K1,K2,K3之间的关系为K2=______________,△H3=_____________
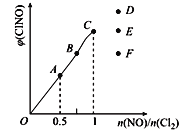
(2)已知2NO(g)+Cl2(g)![]() 2ClNO(g),一定条件下在恒温恒容的密闭容器中按一定比例,充入NO(g)和Cl2(g),平衡时ClNO的体积分数随n(NO)/n(C12)的变化图象如图,则A、B、C三状态中,NO的转化率最大的是___点,当n(NO)/n(C12)=1.5时,达到平衡状态ClNO的体积分数可能是D、E、F三点中的_____点。
2ClNO(g),一定条件下在恒温恒容的密闭容器中按一定比例,充入NO(g)和Cl2(g),平衡时ClNO的体积分数随n(NO)/n(C12)的变化图象如图,则A、B、C三状态中,NO的转化率最大的是___点,当n(NO)/n(C12)=1.5时,达到平衡状态ClNO的体积分数可能是D、E、F三点中的_____点。
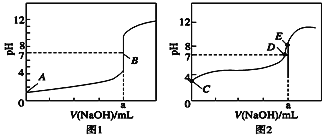
(3)常温下,用0.100 0 mol·L-1 NaOH溶液分别滴定20.00 mL 0.100 0 mol·L-1 HBr溶液和20.00 mL0.100 0 mol·L-1 CH3COOH溶液,得到2条滴定曲线,如图所示:
①根据图1和图2判断,滴定HBr溶液的曲线是______________(填“图1”或“图2”);
②a=______ mL; ③c(Na+)=c(CH3COO-)的点是______点;
④E点对应溶液中离子浓度由大到小的顺序为_______________。
(4) 氨气燃料电池,一极通入氨气,另一极通入空气,电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,它在熔融状态下能传导O2-。写出负极的电极反应式_____________。
(5) 已知:CdCO3、NiCO3溶度积分别为6.0×10-12、1.0×10-7。p(CO32-)=-lg c(CO32-) 。在含Cd2+、Ni2+浓度均为0.01 mol/L的废水中滴加稀碳酸钠溶液。为了分离这两种阳离子,需要控制p(CO32-)范围为_____________(忽略溶液体积的变化)
A.4≤p(CO32-)≤6
B.5<p(CO32-)≤ 7-lg6
C.7-lg6<p(CO32-)≤ 8
D.7<p(CO32-)≤8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数,下列叙述中正确的是( )
A.在标准状态下,1L庚烷完全燃烧后,所生成的气态产物的分子数为![]() NA
NA
B.1mol碳正离子CH5+所含的电子数为11NA
C.标准状态下,16g甲烷完全燃烧所消耗的氧气的分子数为2NA
D.0.5molC3H8分子中含C﹣H共价键2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下表中,只用一种试剂Z来检验盐溶液中的离子X。在同时有离子Y存在时,此检验仍可以判断的是( )
试剂Z | 离子X | 离子Y | |
A | Na2CO3 | Ca2+ | Ba2+ |
B | AgNO3 | Cl- | CO32- |
C | Na2SO4 | Ba2+ | Mg2+ |
D | Ba(NO3)2 | SO42- | CO32- |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,正确的是
A.铝和酸、碱反应都表现出较强的还原性
B.铝箔在空气中受热熔化并迅速燃烧
C.钠燃烧后得到白色固体
D.自然界中钠以过氧化钠、氢氧化钠和氯化钠等形式存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂离子电池的应用很广,一种利用钛铁矿[主要成分为偏钛酸亚铁(FeTiO3),含有少量Fe2O3]制取钛白粉(TiO2)和利用其副产物制取锂离子电池的正极材料(LiFePO4)的工艺流程如下(部分条件未给出)。

(1)FeTiO3中Ti的化合价为______;在“还原”步骤中,还原“Fe3+”的反应中氧化剂和还原剂的物质的量之比为__________。
(2)FeSO4溶解度与温度关系如下表,
温度(℃) | 30 | 20 | l5 | l0 | 5 | 0 | -2 | -6 |
FeSO4 (g/L) | 240 | 190 | 130 | 117 | 95 | 79 | 59 | 38 |
则操作I 的名称为_______、过滤。
(3)“转化” 步骤中对溶液进行加热的主要目的是_____________。
(4)写出“沉铁”的离子反应方程式___________,为使Fe3+完全沉降,则PO43-的浓度至少应为___________(己知:Ksp (FePO4· 2H2O) = 9.91×10-16)。
(5)流程中可循环利用的物质是(H2O除外)______,写出固相焙烧的反应方程式______。
(6)某锂离子充放电时,正极发生LiFePO4与FePO4的转化,当充电时,电池负极发生的
反应为6C+xLi++xe-=LixC6,写出放电时电池反应方程式______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com