
【题目】某温度下,反应N2O4(g)![]() 2NO2(g)△H>0,在密闭容器中达到平衡。下列说法不正确的是( )
2NO2(g)△H>0,在密闭容器中达到平衡。下列说法不正确的是( )
A. 加压时(体积变小),将使正反应速率增大
B. 保持体积不变,升高温度,再达平衡时颜色变深
C. 保持体积不变,加入少许N2O4,再达到平衡时,颜色变深
D. 保持体积不变,加入少许NO2,将使正反应速率减小
科目:高中化学 来源: 题型:
【题目】下列物质在水溶液中的电离方程式,正确的是( )
A.CH3COOH![]() H++CH3COO-B.KClO3=K++Cl-+3O2-
H++CH3COO-B.KClO3=K++Cl-+3O2-
C.H2CO3![]() 2H++CO32-D.NaHSO4=Na++HSO4-
2H++CO32-D.NaHSO4=Na++HSO4-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应A(g)+3B(g) =2C(g),下列各数据表示不同条件下的反应速率,其中反应进行得最快的是( )
A. v(A)=0.01 mol/(Ls) B. v(B)=0.02 mol/(Ls)
C. v(B)=0.60mol/(Lmin) D. v(C)=1.0mol/(Lmin)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将AgNO3溶液分别滴加到浓度均为0.01mol/L的NaBr、Na2SeO3溶液中,所得的沉淀溶解平衡曲线如图所示(Br-、SeO32-用Xn-表示,不考虑SeO32-的水解)。下列叙述正确的是

A. Ksp(Ag2SeO3)的数量级为10-10
B. d点对应的AgBr溶液为不饱和溶液
C. 所用AgNO3溶液的浓度为10-3 mol/L
D. Ag2SeO3(s)+2Br-(aq)==2AgBr(s)+SeO32- (aq)平衡常数为109.6,反应趋于完全
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据A~E几种烃分子的示意图填空。

(1)A分子的空间构型为___________。
(2)B的名称是___________。
(3)D的分子式是___________。
(4)C、E的关系是___________(填“同系物”或“同分异构体”或“同一种物质”)。
(5)A~E表示的物质中,能发生加成反应的两种物质是___________(填序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值。下列说法正确的是
A. 5.6g铁与稀硝酸反应,转移电子数一定为0.3NA
B. 密闭容器中,1molN2和3molH2催化反应后分子总数大于2NA
C. 3.2gN2H4中含有共用电子对的总数为0.6NA
D. 室温下,pH=1的H3PO4溶液中,含有0.1NA个H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“玉兔”号月球车用![]() Pu作为热源材料。下列关于
Pu作为热源材料。下列关于![]() Pu的说法正确的是( )
Pu的说法正确的是( )
A.![]() Pu与
Pu与![]() 互为同位素
互为同位素
B.![]() Pu与
Pu与![]() Pu具有相同的中子数
Pu具有相同的中子数
C.![]() Pu与
Pu与![]() U具有完全相同的物理性质和化学性质
U具有完全相同的物理性质和化学性质
D.![]() Pu与
Pu与![]() Pu具有相同的电子层结构
Pu具有相同的电子层结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【加试题】六氨氯化镁 (MgCl2·6NH3)具有极好的可逆吸、放氨特性,是一种优良的储氨材料。某研究小组在实验室以菱镁矿(主 要成分 MgCO3,含少量 FeCO3等杂质)为原料制备六氨氯化镁,实验流程图如下:
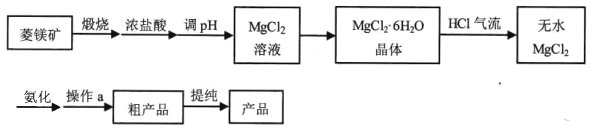
其中氨化过程装置示意图如下:
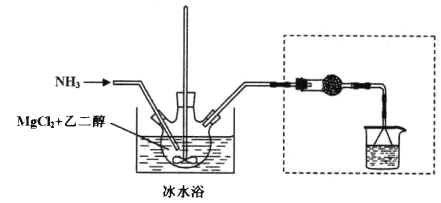
己知:(1)与Mg2+结合能力: H2O>NH3>HOCH2CH2OH>CH3OH
(2)相关物质的性质见下表:
物质名称 | 氨气的溶解性 | 氯化镁的溶解性 | 六氨氯化镁的溶解性 |
水 | 易溶 | 易溶 | 易溶 |
甲醇(沸点65℃) | 易溶 | 易溶 | 难溶 |
乙二醇(沸点197℃) | 易溶 | 易溶 | 难溶 |
请回答:
(1)调 pH适合的物质是________ (填化学式)。
(2)在空气中直接加热MgCl2·6H2O晶体得不到纯的无水MgCl2,原因是________(用化学方程式表示)。
(3)虚框内装置的作用: _______,操作a的名称是_________。
(4)提纯操作中,下列洗涤剂最合适的是_______。
A.冰浓氨水 B.乙二醇和水的混合液
C.氨气饱和的甲醇溶液 D.氨气饱和的乙二醇溶液
(5)制得产品后,该科研小组对产品的成分进行测定,其中氯离子含量检测方法如下:
a.称取1.420g样品,加足量硫酸溶解,配制成250mL溶液;
b.量取25.00mL待测液于锥形瓶中;
c.用0.2000mol/LAgNO3标准溶液滴定至终点,记录消耗AgNO3标准溶液的体积;
d.重复b、c操作2~3次,平均消耗AgNO3标准溶液10.00mL。
① 配制样品溶液时加硫酸的原因___________。
② 该样品中氯离子百分含量为____________。
③ 将氯离子百分含量实验值与理论值 (36.04%)相比较,请分析造成此结果的可能原因有_________(己知滴定操作正确、硫酸根离子对检测无影响)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是金属镁和卤素单质(X2)反应的能量变化示意图。

下列说法正确的是
A. 卤素单质(X2)与水反应均可生成两种酸
B. 用电子式表示MgF2的形成过程为: ![]()
C. 热稳定性:MgI2>MgBr2>MgCl2>MgF2
D. 由图可知此温度下MgI2(s)与Cl2(g)反应的热化学方程式为:MgI2(s)+Cl2(g)=MgCl2(s)+I2(g),ΔH=-277kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com