
【题目】写出下列各烷烃的分子式。
(1)烷烃A在同温同压下蒸气的密度是H2的43倍:________。
(2)烷烃B的碳原子数是5:________。
(3)分子中含有26个电子的烷烃C:________。
(4)室温下相对分子质量最大的气态直链烷烃D:________。
【答案】C6H14 C5H12 C3H8 C4H10
【解析】
烷烃的通式CnH(2n+2),据此分析;
(1)根据密度之比等于摩尔质量之比进行计算;
(2)根据烷烃的通式和B的分子中含有5个碳原子,计算氢原子的个数,写出分子式;
(3)一个碳原子中有6个电子,一个氢原子中有1个电子,结合通式列式计算出n,写出分子式;
(4)室温下相对分子质量最大的气态直链烷烃为正丁烷,以此书写分子式。
烷烃的通式为:CnH(2n+2),烷烃的相对分子量为:14n+2。
(1)密度之比等于摩尔质量之比,就等于相对分子量之比,A的相对分子质量为:14n+2=86,n=6,即该烷烃的分子式为C6H14。
(2)烷烃B的分子中含有5个碳原子,即2n+2=2![]() 5+2=12,所以B的分子式为C5H12;
5+2=12,所以B的分子式为C5H12;
(3)由CnH(2n+2),可知,6n+2n+2=26,n=3,该烷烃的分子式为C3H8;
(4)室温下相对分子质量最大的气态直链烷烃应为CH3CH2CH2CH3,分子式为C4H10。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】氮是极其重要的化学元素。我国科学家最近成功合成了超高含能材料聚合氮和金属氮。基于氮气的能源研究也是未来能源发展的重要方向。
(1)基态氮原子的价电子排布式为___________。
(2)14g氮气分子中原子轨道以“头碰头”方式形成的共价键数目为___________,以“肩并肩”方式形成的共价键数目为___________。
(3)C、N、O三种元素按第一电离能从大到小的排列顺序为___________。已知氧的第一电离能为1369kJ·mol-1、第二电离能为3512kJ·mol-1、第三电离能为5495 kJ·mol-1,其第二电离能增幅较大的原因是___________。
(4)某含氨配合物CrCl3·6NH3的化学键类型有配位键、极性共价键和___________。CrCl3·6NH3有三种异构体,分别是[Cr(NH)3)6]Cl3、___________、[Cr(NH)4Cl2] Cl·2NH3。
(5)NH4N3是在的高能量度材料,其品胞构如图所示。N3-是直线型结构,N3-中氮原子的杂化类型是___________。NH4+的 VSEPR模型名称为___________。

(6)已知NH4N3的晶胞参数为anm和0.5anm,阿伏加德罗常数的值为NA,则NH4N3的密度为___________g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室为探究铁与浓硫酸(足量)的反应,并验证SO2的性质,设计如图所示装置进行实验,下列说法不正确的是( )
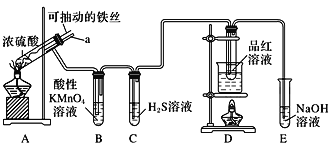
A.装置B中酸性KMnO4溶液逐渐褪色,体现了二氧化硫的还原性 |
B.实验结束后可向装置A的溶液中滴加KSCN溶液以检验生成的Fe3+ |
C.装置D中品红溶液褪色可以验证SO2的漂白性 |
D.实验时将导管a插入浓硫酸中,可防止装置B中的溶液倒吸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题
学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理请回答下列问题:
(1)常温下,某纯碱溶液中滴入酚酞,溶液呈红色,则该溶液呈 ______性,原因是________________;用离子方程式表示
(2)在常温下将pH=2的盐酸10mL加水稀释到1L,则稀释后的溶液的pH值等于 ______________;
(3)已知在H2S溶液中存在下列平衡: H2S![]() H++HS-
H++HS-
向H2S溶液中加入NaOH固体时,不考虑温度变化电离平衡向______移动,填“左”或“右”),c(H+)______。(填“增大”、“减小”或“不变”
向H2S溶液中加入NaHS固体时,电离平衡向______移动,填“左”或“右”)c(S2—)______。(填“增大”、“减小”或“不变”)

(4)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示。则图中表示醋酸溶液中pH变化曲线的是 ______ 填“A”或“B”;设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为m2,则m1______ m2。 (选填“![]() ”、“
”、“![]() ”、“
”、“![]() ”
”
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂亚硫酰氯(Li/SOCl2)电池是实际应用电池系列中比能量最高的一种电池,剖视图如图所示,一种非水的LiAlCl4的SOCl2溶液为电解液。亚硫酸氯既是电解质,又是正极活性物质,其中碳电极区的电极反应式为2SOCl2+4e-=4Cl-+S+SO2↑,该电池工作时,下列说法错误的是( )

A. 锂电极区发生的电极反应:Li-e-=Li+
B. 放电时发生的总反应:4Li+2SOCl2=4LiCl+SO2↑+S
C. 锂电极上的电势比碳电极上的低
D. 若采用水溶液代替SOCl2溶液,电池总反应和效率均不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用反应6NO2+8NH3===7N2+12H2O构成电池的装置如图所示。此方法既能实现有效清除氮氧化物的排放,减轻环境污染,又能充分利用化学能。下列说法正确的是()

A. 电流从左侧电极经过负载后流向右侧电极
B. 为使电池持续放电,离子交换膜需选用阴离子交换膜
C. 电极A极反应式为2NH3-6e-===N2+6H+
D. 当有4.48 L NO2被处理时,转移电子数为0.8NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:2NO2(红棕色)![]() N2O4(无色)△H<0。将一定量的NO2充入注射器中后封口,下图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是
N2O4(无色)△H<0。将一定量的NO2充入注射器中后封口,下图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是

A. b点的操作是拉伸注射器
B. d点:v(正)< v(逆)
C. c点与a点相比,c(NO2)增大,c(N2O4)减小
D. 若不忽略体系温度变化,且没有能量损失,则T(b)>T(c)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数,下列叙述中正确的是( )
A.常温常压下,11.2L氧气所含的原子数为NA
B.1.8gNH4+离子中含有的电子数为NA
C.常温常压下,48gO3含有的氧原子数为NA
D.5.6g金属铁与足量氯气充分反应时失去的电子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸晶体的组成可表示为H2C2O4·xH2O,为了测定x值,进行下述实验:
①称取n g草酸晶体配成100.00 mL水溶液;
②取25.00 mL所配制的草酸溶液置于锥形瓶中,加稀硫酸,用浓度为a mol·L-1的KMnO4溶液滴定,试回答下列问题:
(1)写出滴定实验中所发生反应的化学方程式:_______________
(2)实验中KMnO4溶液应装在____式滴定管中,滴定终点的判断依据是________________
(3)滴定过程中用去V mL a mol·L-1的KMnO4溶液,则所配制的草酸的物质的量浓度为_______mol·L-1
(4)若滴定终点读数时目光俯视,则计算出的x值可能___________(填偏大、偏小、无影响)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com