
【题目】工业上可通过煤的液化合成甲醇,主反应为:
CO(g)+2H2(g) ![]() CH3OH(1) △H=xkJ/mol
CH3OH(1) △H=xkJ/mol
(1)己知常温下CH3OH(1)、H2和CO的燃烧热分別为726.5kJ/mol、285.5kJ/mol、283.0kJ/mol,则x=___________;为提高合成甲醇反应的选择性,关键因素是___________。
(2)TK下,在容积为1.00L的某密闭容器中进行反应CO(g)+2H2(g) ![]() CH3OH(g) △H<0,相关数据如图。
CH3OH(g) △H<0,相关数据如图。
①该反应0~10min的平均速率υ(H2)___________mol/(L·min);M和N点的逆反应速率较大的是___________(填“υ逆(M)”、“υ逆(N)”或“不能确定”)。
②10min时容器内CO的体积分数为___________。
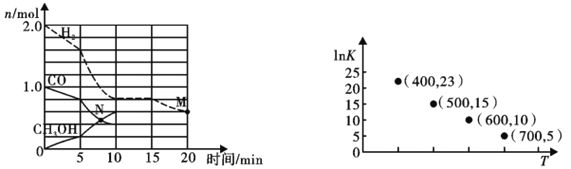
③对于气相反应,常用某组分(B)的平衡压强(PB)代替物质的量浓度(cB)表示平衡常数(以Kp表示),其中PB=P总×B的体积分数。若在TK下平衡气体总压强为xMPa,则该反应的平衡常数Kp=___________(写出表达式,不必化简)。实验测得不同温度下的lnKp(化学平衡常数Kp的自然对数)如图,请分析lnKp随T呈现上述变化趋势的原因______________________。
【答案】-127.5 催化剂 0.12 不能确定 22.22% 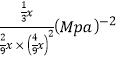 该反应正反应为放热反应,当温度升高平衡逆向移动,平衡常数(Kp或lnKp)减小。
该反应正反应为放热反应,当温度升高平衡逆向移动,平衡常数(Kp或lnKp)减小。
【解析】
(1)根据盖斯定律计算x值;根据催化剂具有选择性分析;(2) ①根据![]() 计算;N未平衡,反应正向进行, M点为平衡后反应正向移动的点,增大压强、减少生成物浓度都能使平衡正向移动; ②10min时容器内CO的体积分数为
计算;N未平衡,反应正向进行, M点为平衡后反应正向移动的点,增大压强、减少生成物浓度都能使平衡正向移动; ②10min时容器内CO的体积分数为![]() ;③根据Kp=P(CH3OH)/[P(CO)·P2(H2)] 计算;该反应正反应为放热反应,当温度升高平衡逆向移动。
;③根据Kp=P(CH3OH)/[P(CO)·P2(H2)] 计算;该反应正反应为放热反应,当温度升高平衡逆向移动。
(1)CO(g)燃烧的热化学方程式为CO(g)+1/2 O2(g)= CO2(g) ΔH=—283.0 kJ/mol ①; CH3OH(l) 燃烧的热化学方程式为CH3OH(l) +3/2 O2(g)= CO2(g)++ 2H2O(l) ΔH= —726.5 kJ/mol ②;H2(g)燃烧的热化学方程式为H2 (g)+1/2 O2(g)= H2O(l) ΔH=—285.5kJ/mol③;①+③![]() -②可得:CO(g)+2H2(g)
-②可得:CO(g)+2H2(g) ![]() CH3OH(1) ΔH=-127.5 kJ/mol;催化剂具有选择性,为提高合成甲醇反应的选择性,关键因素是选择合适的催化剂;
CH3OH(1) ΔH=-127.5 kJ/mol;催化剂具有选择性,为提高合成甲醇反应的选择性,关键因素是选择合适的催化剂;
(2) ①该反应0~10min的平均速率υ(H2)=![]() 0.12 mol/(L·min); N点未平衡,反应正向进行,υ逆(N)小于平衡时的逆反应速率,M点为平衡后反应正向移动的点,若增大压强使平衡正向移动,则υ逆(M)大于平衡时的逆反应速率,若减少生成物浓度使平衡正向移动,则υ逆(M)小于平衡时的逆反应速率;所以不能确定M和N点的逆反应速率大小;②10min时容器内CO的体积分数为
0.12 mol/(L·min); N点未平衡,反应正向进行,υ逆(N)小于平衡时的逆反应速率,M点为平衡后反应正向移动的点,若增大压强使平衡正向移动,则υ逆(M)大于平衡时的逆反应速率,若减少生成物浓度使平衡正向移动,则υ逆(M)小于平衡时的逆反应速率;所以不能确定M和N点的逆反应速率大小;②10min时容器内CO的体积分数为![]() 22.22%;
22.22%;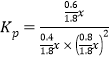 =
=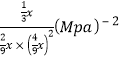 ;该反应正反应为放热反应,当温度升高平衡逆向移动,平衡常数(Kp或lnKp)减小。
;该反应正反应为放热反应,当温度升高平衡逆向移动,平衡常数(Kp或lnKp)减小。


科目:高中化学 来源: 题型:
【题目】Ⅰ.如图1所示是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:
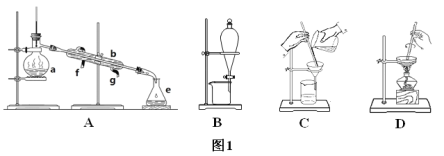
(1)从氯化钾溶液中得到氯化钾固体选择装置___(填代表装置图的字母,下同);除去自来水中的氯离子等杂质选择装置____。
(2)从碘水中分离出I2选择装置_____,该分离方法的名称为____。
(3)装置A中仪器a的名称是_____,进水的方向是____。
Ⅱ.海水中蕴藏着丰富的资源,在实验室中取少量海水,进行如图2流程的实验:

(1)粗盐中含Ca2+、Mg2+、SO42-等杂质,需要提纯后才能综合利用。粗盐提纯的步骤有: ①加入过量的Na2CO3溶液②加入过量的BaCl2溶液;③加入过量的NaOH溶液;④加入盐酸调节溶液至中性;⑤溶解;⑥过滤;⑦蒸发。正确的操作顺序是(填写序号字母)______。
a.⑤②③①④⑥⑦ b.⑤①②③⑥④⑦ c.⑤②①③④⑥⑦ d.⑤③②①⑥④⑦
(2)由海水到氯化钠晶体的实验过程中要用到的主要装置是(从图1中给定的四种装置中选择)____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡,它们都可看作化学平衡.请根据所学知识的回答:
(1)实验测得室温下0.1mol/LNaHCO3溶液的pH>7,则Na+、HCO3-、H2CO3、CO32-、OH-五种微粒的浓度由大到小的顺序为:_______________________________________________________________。
(2)含有足量AgCl固体的饱和溶液中,氯化银在水中存在沉淀溶解平衡:AgCl(s)![]() Ag+(aq)+Cl-(aq)。在25℃时,氯化银的Ksp=1.8×10-10mol2/L2.现将足量氯化银分别放入:
Ag+(aq)+Cl-(aq)。在25℃时,氯化银的Ksp=1.8×10-10mol2/L2.现将足量氯化银分别放入:
① 100mL蒸馏水中;
② 100mL 0.2mol/LAgNO3溶液中;
③ 100mL 0.1mol/L氯化铝溶液中;
④ 100mL 0.1mol/L盐酸溶液中.
充分搅拌后,相同温度下银离子浓度由大到小的顺序_________________________(填写序号);②中氯离子的浓度为_________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是元素周期表的一部分

(1)②号元素原子的电子式_________________
(2)某些不同族元素的性质也有一定的相似性,如上表中元素⑦与元素②的氢氧化物有相似的性质。写出元素②的氢氧化物与NaOH溶液反应的离子方程式___________________________
(3)元素③和⑤可以原子个数比1:2 形成化合物,请在①-⑩号元素中选择元素组合,写出与它互为等电子体的一种分于化学式___________、一种离子的化学式__________________。
(4)⑩号元素的+3 价离子能与④、⑤的氢化物形成配位数为6 的络合物。且相应两种配体的物质的量之比为2:1,写出配离子的化学式_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知MnO2为黑色难溶于水的固体,实验室制取氧气的反应为2KClO3![]() 2KCl+3O2↑,反应后从剩余固体中回收二氧化锰的操作顺序正确的是( )
2KCl+3O2↑,反应后从剩余固体中回收二氧化锰的操作顺序正确的是( )
A. 溶解、过滤、蒸发、洗涤 B. 溶解、过滤、洗涤、加热
C. 溶解、蒸发、洗涤、过滤 D. 溶解、洗涤、过滤、加热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述中不正确的是( )
A. NH4 键角等于109.28°
B. SnBr2 键角大于 120°
C. SF6 中有 6 对完全相同的成键电子对
D. SiF4 和 SO42 的中心原子均为sp3杂化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,①5gH2 ②11.2LO2 ③2molH2O ④6.02×1023个 CO2分子。
(1)所含分子数最多的是_________(请用序号回答,下同);
(2)所含原子数最多的是_________;
(3)质量最大的是_________;
(4)体积最大的是_________;
(5) 气体密度最大的是_________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于原电池的说法中,错误的是( )
A. 原电池是一种将化学能直接转化为电能的装置B. 原电池中,正极发生氧化反应
C. 原电池的电子从负极经导线流向正极D. 原电池的负极材料一般比正极活泼
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某制碱厂的生产流程示意图如下:

下列分析正确的是( )
A. 该制碱法是侯氏制碱法 B. 反应①中包含复分解反应
C. X中只含有Ca2+和Cl— D. 理论上,生产过程中无需补充CO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com