
【题目】在标准状况下,①5gH2 ②11.2LO2 ③2molH2O ④6.02×1023个 CO2分子。
(1)所含分子数最多的是_________(请用序号回答,下同);
(2)所含原子数最多的是_________;
(3)质量最大的是_________;
(4)体积最大的是_________;
(5) 气体密度最大的是_________;
【答案】① ③ ④ ① ④
【解析】
结合n=![]() =
=![]() =
=![]() 结合分子构成以及ρ=
结合分子构成以及ρ=![]() =
=![]() =
=![]() 计算相关物理量。
计算相关物理量。
①5gH2 的物质的量为![]() 2.5mol,含有原子数目为5NA,标准状况下体积为2.5mol×22.4L/mol=56L;②11.2LO2 的物质的量为
2.5mol,含有原子数目为5NA,标准状况下体积为2.5mol×22.4L/mol=56L;②11.2LO2 的物质的量为![]() =0.5mol,含有的原子总数为1NA,质量为0.5mol×32g/mol=16g;③2molH2O的质量为2mol×18g/mol=36g,标准状况下水为液体,其体积为36mL,含有的原子数目为6NA;④6.02×1023个 CO2分子的气体的物质的量为
=0.5mol,含有的原子总数为1NA,质量为0.5mol×32g/mol=16g;③2molH2O的质量为2mol×18g/mol=36g,标准状况下水为液体,其体积为36mL,含有的原子数目为6NA;④6.02×1023个 CO2分子的气体的物质的量为![]() mol=1mol,含有的原子数目为3NA,质量为1mol×44g/mol=44g;则:
mol=1mol,含有的原子数目为3NA,质量为1mol×44g/mol=44g;则:
(1)由N=n×NA可知分子数目与物质的量成正比,则所含分子数最多的是①;
(2)由分析知,所含原子数最多的是③;
(3)由分析知,质量最大的是④;
(4)体积最大的是①;
(5)在①5gH2 ②11.2LO2 ③2molH2O ④6.02×1023个 CO2中,水为液体,由ρ=![]() 可知,气体密度与摩尔质量成正比,则气体密度最大的是④。
可知,气体密度与摩尔质量成正比,则气体密度最大的是④。


科目:高中化学 来源: 题型:
【题目】如图为实验室制取纯净、干燥的Cl2,并进行检验Cl2性质实验的装置。其中E瓶中放有干燥红色布条;F中为铜网,F右端出气管口附近放有脱脂棉。

(1)A与B二者反应的化学方程式为____。
(2)在上述反应中,如有1 molCl2生成,被氧化的HCl的物质的量是___,转移电子的数目是___。
(3)C中试剂是___;D中试剂的作用是___。
(4)E中现象是_____。
(5)H中试剂为_____,作用是_____。
(6)整套装置中有两处用酒精灯加热,两处酒精灯点燃的先后顺序是___、__。(用①或②填写)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可通过煤的液化合成甲醇,主反应为:
CO(g)+2H2(g) ![]() CH3OH(1) △H=xkJ/mol
CH3OH(1) △H=xkJ/mol
(1)己知常温下CH3OH(1)、H2和CO的燃烧热分別为726.5kJ/mol、285.5kJ/mol、283.0kJ/mol,则x=___________;为提高合成甲醇反应的选择性,关键因素是___________。
(2)TK下,在容积为1.00L的某密闭容器中进行反应CO(g)+2H2(g) ![]() CH3OH(g) △H<0,相关数据如图。
CH3OH(g) △H<0,相关数据如图。
①该反应0~10min的平均速率υ(H2)___________mol/(L·min);M和N点的逆反应速率较大的是___________(填“υ逆(M)”、“υ逆(N)”或“不能确定”)。
②10min时容器内CO的体积分数为___________。
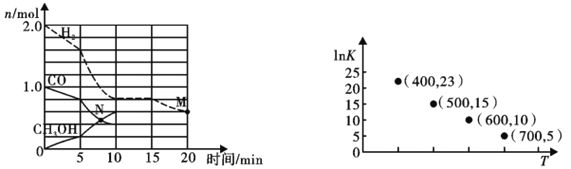
③对于气相反应,常用某组分(B)的平衡压强(PB)代替物质的量浓度(cB)表示平衡常数(以Kp表示),其中PB=P总×B的体积分数。若在TK下平衡气体总压强为xMPa,则该反应的平衡常数Kp=___________(写出表达式,不必化简)。实验测得不同温度下的lnKp(化学平衡常数Kp的自然对数)如图,请分析lnKp随T呈现上述变化趋势的原因______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度压强下,用相同质量的CH4、CO2、O2、SO2四种气体分别吹出四个体积大小不同的气球,下列说法中正确的是

A. 气球B中装的是O2B. 气球A和气球D中气体物质的量之比为4:1
C. 气球A和气球C中气体分子数相等D. 气球C和气球D中气体密度之比为2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)二水合草酸镓的结构如图所示,其中镓原子在周期表中的位置为__________,草酸根中碳原子的杂化方式为__________。

(2)琥珀酸亚铁片是用于缺铁性贫血的预防和治疗的常见药物,其中“亚铁”是关键成分,K3[Fe(CN)6]溶液是检验 Fe2+的试剂,1mol CN-中含 π 键的数目为______ ,临床建议服用维生素 C 促进“亚铁”的吸收,避免生成 Fe3+,从原子结构角度来看,Fe2+易被氧化成 Fe3+的原因是___________。
(3)化合物(CH3)3N 与盐酸反应生成[(CH3) 3NH]+,该过程新生成的化学键为______(填序号)
a. 离子键 b. 配位键 c. 氢键 d. 非极性共价键
若化合物(CH3)3N 能溶于水,试解析其原因____________________。
(4)Cu2+等过渡元素水合离子是否有颜色与原子结构有关,且存在一定的规律。试推断 Ni2+的水合离子为 __________(填“有”或“无”)色离子,依据是_____________。
离子 | Sc3+ | Ti3+ | Fe2+ | Cu2+ | Zn2+ |
颜色 | 无色 | 紫红色 | 浅绿色 | 蓝色 | 无色 |
(5)元素铜与镍的第二电离能分别为:ICu=1959kJ·mol-1、INi=1753kJ·mol-1,ICu>INi的原因是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在南朝刘宋雷敩所著的《雷公炮炙论》中收录了一种矿物类药材石髓铅,又称自然铜,具有活血化瘀止痛的效果。今用现代分析技术检测一份石髓铅样品,发现其含铜极少,含有铁元素的质量分数为44.8%,硫元素的质量分数为51.2%。回答下列问题:
(1)石髓铅的主要成分是一种化合物(质量分数为96%),化学式为_________;石髓铅粉末几乎能完全溶于硫酸酸化的高锰酸钾溶液中,形成多种硫酸盐的混合液,写出主要反应的离子方程式:______________________。
(2)利用石髓铅、焦炭和氧气在高温下反应可制造硫磺,副产品为Fe3O4和CO。Fe3O4是_____色晶体,可用于制作复印机的墨粉,CO可用于合成在纺织工业中广泛使用的保险粉(Na2S2O4),其流程如下:

合成塔I中得到的HCOONa溶液溶质质量分数约为5%,从中分离出HCOONa·2H2O的主要步骤是、______、过滤、洗涤、干燥;合成塔II中发生主要反应的化学方程式为____________。保险粉暴露在空气中易吸收氧气和水蒸气而变质,当吸收自身物质的量一半的氧气和一定量水蒸汽时,变质形成____________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤是重要能源。燃煤会释放SO2、CO等有毒气体。消除有毒气体的研究和实践从未停止。完成下列填空:
I.用CaSO4消除CO。CaSO4和CO可发生如下两个反应:
反应①:CaSO4(s)+4CO(g)![]() CaS(s)+4CO2(g)+175.6kJ
CaS(s)+4CO2(g)+175.6kJ
反应②:CaSO4(s)+4CO(g)![]() CaO(s)+SO2(g)+CO2(g)—218.4kJ
CaO(s)+SO2(g)+CO2(g)—218.4kJ
(1)写出反应①的平衡常数表达式:_____________;一定条件下的密闭容器中,两反应均达平衡后,若使反应①K的减小,需要改变的反应条件是______________,则反应②的K___________(选填编号)、反应①的v(CO2)正__________(选填编号)。
a. 增大 b. 减小 c. 不变 d. 无法判断
(2)补全下图中反应②的能量变化示意图_______________(即,注明生成物能量的大致位置及反应热效应数值)

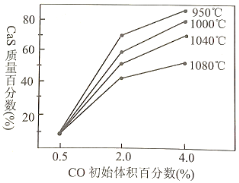
(3)下图是不同温度下,CO初始体积百分数与平衡时固体产物中CaS质量百分数的关系曲线。写出两种降低SO2生成量的措施___________________________________。
II. Fe2(SO4)3溶液可除去煤中以黄铁矿(FeS2)形式存在的硫元素,反应如下:8H2O + FeS2+ 7Fe2(SO4)3→15FeSO4+ 8H2SO4
(4)标出电子转移的数目和方向________;还原产物是_______。
(5)检验上述反应中Fe2(SO4)3是否消耗完的实验方案:___________________________。
(6)该方法的优点之一是Fe2(SO4)3易再生。向反应后的溶液中通入___________,就能达到使Fe2(SO4)3再生的目的,方便且价廉。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com