
【题目】Ⅰ.如图1所示是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:
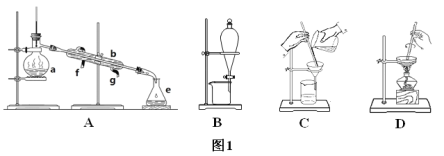
(1)从氯化钾溶液中得到氯化钾固体选择装置___(填代表装置图的字母,下同);除去自来水中的氯离子等杂质选择装置____。
(2)从碘水中分离出I2选择装置_____,该分离方法的名称为____。
(3)装置A中仪器a的名称是_____,进水的方向是____。
Ⅱ.海水中蕴藏着丰富的资源,在实验室中取少量海水,进行如图2流程的实验:

(1)粗盐中含Ca2+、Mg2+、SO42-等杂质,需要提纯后才能综合利用。粗盐提纯的步骤有: ①加入过量的Na2CO3溶液②加入过量的BaCl2溶液;③加入过量的NaOH溶液;④加入盐酸调节溶液至中性;⑤溶解;⑥过滤;⑦蒸发。正确的操作顺序是(填写序号字母)______。
a.⑤②③①④⑥⑦ b.⑤①②③⑥④⑦ c.⑤②①③④⑥⑦ d.⑤③②①⑥④⑦
(2)由海水到氯化钠晶体的实验过程中要用到的主要装置是(从图1中给定的四种装置中选择)____。
【答案】D A B 萃取、分液 蒸馏烧瓶 下口进水 d CD
【解析】
Ⅰ.(1)从氯化钾溶液中得到氯化钾固体采用蒸发溶剂的方法,所以选择装置D;除去自来水中的氯离子等杂质可以用蒸馏的方法,所以选择装置A。
(2)利用碘不易溶于水但易溶于有机溶剂的性质,从碘水中分离出I2可以选择合适的萃取剂进行萃取,然后分液,所以选择装置B,故答案为:B,萃取、分液。
(3)装置A中仪器a是蒸馏烧瓶,为了充分冷凝气体,冷凝管中水的流向和气体的流向应该相反,所以从冷凝管的下口进水。故答案为:蒸馏烧瓶,下口。
Ⅱ.(1)先把粗盐溶于水,用过量的NaOH溶液除去粗盐中含有的Mg2+,用过量的BaCl2溶液除去SO42-,用过量的Na2CO3溶液除去Ca2+和过量的Ba2+,然后过滤,再向滤液中加入盐酸至中性,除去过量的OH-和CO32-,最后蒸发掉水,得到纯净的NaCl。加Na2CO3溶液之前必须先加入BaCl2溶液,利用后加入的Na2CO3溶液除去先加入的过量的Ba2+,过量的CO32-可以利用过滤后加入的盐酸除去,NaOH溶液只要在过滤之前加入即可。所以选d。
(2)由海水到氯化钠晶体,需要先进行海水晒盐,得到的粗盐经提纯(除去粗盐中的泥沙和可溶性杂质离子Ca2+、Mg2+、SO42-等)得到食盐水,最后再蒸发得到纯净的食盐。除去粗盐中的泥沙和可溶性杂质离子Ca2+、Mg2+、SO42-等需要用到过滤的装置,从食盐水中得到食盐需要蒸发,所以选择装置CD。


科目:高中化学 来源: 题型:
【题目】如图所示是425℃时,在1 L密闭容器中发生化学反应的浓度随时间的变化示意图。

下列叙述错误的是( )
A. 图①中t0时,三种物质的物质的量相同
B. 图①中t0时,反应达到平衡状态
C. 图②中的可逆反应为2HI(g) ![]() H2(g)+I2(g)
H2(g)+I2(g)
D. 图①②中当c(HI)=3.16 mol/L时,反应达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是( )
A.臭氧的摩尔质量是48 g
B.同温同压条件下,等质量的氧气和臭氧体积比为2∶3
C.16 g臭氧中含有6.02×1023个原子
D.1.00 mol臭氧中含有电子总数为18×6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外活动小组用海带为原料制取了少量碘水。现用CCl4从碘水中萃取碘并用分液漏斗分离两种溶液。其实验操作可分解为如下几步:
A.把盛有溶液的分液漏斗放在铁架台的铁圈中;
B.把50mL碘水和15mLCCl4加入分液漏斗中,并盖好玻璃塞;
C.检验分液漏斗活塞和上口的玻璃塞是否漏液;
D.倒转漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗方正;
E.旋开活塞,用烧杯接收下层液体;
F.从分液漏斗口倒出上层水溶液;
G.将漏斗上口玻璃塞打开或使塞上的凹槽或小孔对准漏斗上的小孔;
H.静置、分层。
(1)上述E步骤的操作中应注意:________。
(2)上述G步骤的操作的目的是:________。
(3)能用CCl4从碘水中萃取碘的原因是_____。
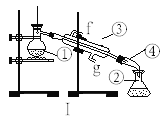
(4)若利用装置I分离四氯化碳和碘的混合物,还缺少的仪器有______,将仪器补充完整后进行的实验操作的名称为:_____,仪器③和④的名称:③______④______;现需配制250ml0.2 mol/LNaCl溶液,装置II是某同学转移溶液的示意图,图中的错误是_______ ,________

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在一个密闭容器中进行如下反应:NO(g)+CO(g) ![]()
![]() N2(g)+CO2(g) ΔH=-373.2 kJ·mol-1,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是
N2(g)+CO2(g) ΔH=-373.2 kJ·mol-1,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是
A. 加催化剂同时升高温度 B. 加催化剂同时增大压强
C. 升高温度同时充入N2 D. 降低温度同时增大压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积为2L的真空密闭容器中加人1 mol CaCO3,发生反应:CaCO3(s) ![]() CaO(s)+CO2(g)。测得二氧化碳的物质的量浓度随温度的变化如图所示。图中曲线A表示CO2的平衡浓度与温度的关系;B是不同温度下,反应经过相同的时间时,CO2物质的量浓度的变化曲线.
CaO(s)+CO2(g)。测得二氧化碳的物质的量浓度随温度的变化如图所示。图中曲线A表示CO2的平衡浓度与温度的关系;B是不同温度下,反应经过相同的时间时,CO2物质的量浓度的变化曲线.

请回答下列问题:
(1)已知:①CaO(s)+SO2(g)==CaSO3(s) △H1=-402kJ·mol-1
②2CaCO3(s)+2SO2(g)+O2(g)==2CaSO4(s)+2CO2(g) △H2=-2762kJ·mol-1
③2CaSO3(s)+O2(g)==2CaSO4(s) △H3=-2315kJ·mol-1
则:CaCO3(s)==CaO(s)+CO2(g)的△H=____kJ·mol-1
(2)①温度为T5℃时,反应CaCO3(s) ![]() CaO(s)十CO2(g)耗时20s达到平衡,则20s内该反应的反应速率为v(CO2)=____;反应的平衡常数为____mol·L-1。
CaO(s)十CO2(g)耗时20s达到平衡,则20s内该反应的反应速率为v(CO2)=____;反应的平衡常数为____mol·L-1。
②如果该反应的平衡常数K值变大,该反应____(选填编号)。
A.一定向逆反应方向移动 B.在平衡移动时正反应速率先增大后减小
C.一定向正反应方向移动 D.在平衡移动时逆反应速率先减小后增大
(3)在T5℃下,维持温度和容器体积不变,充入CO2气体,则达到平衡时CaCO3的质量____(填“增大”、“减小”或“不变”)。
(4)在T5℃下,反应达到平衡状态后,再压缩容器为1L,重新达到平衡时,CO2的浓度____(填“增大”、“减小”或“不变”)
(5)随着温度的升高,曲线B向曲线A逼近的原因是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为实验室制取纯净、干燥的Cl2,并进行检验Cl2性质实验的装置。其中E瓶中放有干燥红色布条;F中为铜网,F右端出气管口附近放有脱脂棉。

(1)A与B二者反应的化学方程式为____。
(2)在上述反应中,如有1 molCl2生成,被氧化的HCl的物质的量是___,转移电子的数目是___。
(3)C中试剂是___;D中试剂的作用是___。
(4)E中现象是_____。
(5)H中试剂为_____,作用是_____。
(6)整套装置中有两处用酒精灯加热,两处酒精灯点燃的先后顺序是___、__。(用①或②填写)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个10 L的密闭容器发生反应A(g)+B(g) C(g)+D(g),测得平衡常数和温度的关系如下:
温度/ ℃ | 700 | 800 | 830 | 1000 | 1200 |
平衡常数 | 1.7 | 1.1 | K | 0.6 | 0.4 |
回答下列问题:
(1)△H ____________ 0(填“<”或 “>”)。
(2)830℃时,向一个10 L的密闭容器中充入1mol的A和1mol的B,则:
①反应达平衡时,n (D)=0.5 mol,则A的平衡转化率为 ,
②该温度下平衡常数K= 。
(3)判断该反应是否达到平衡的依据为
a.c(A)不再改变 b.混合气体的密度不再改变
c.体系内压强不再改变 d.单位时间内生成C和消耗D的物质的量相等
(4)1200℃时反应C(g)+D(g) A(g)+B(g)的平衡常数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可通过煤的液化合成甲醇,主反应为:
CO(g)+2H2(g) ![]() CH3OH(1) △H=xkJ/mol
CH3OH(1) △H=xkJ/mol
(1)己知常温下CH3OH(1)、H2和CO的燃烧热分別为726.5kJ/mol、285.5kJ/mol、283.0kJ/mol,则x=___________;为提高合成甲醇反应的选择性,关键因素是___________。
(2)TK下,在容积为1.00L的某密闭容器中进行反应CO(g)+2H2(g) ![]() CH3OH(g) △H<0,相关数据如图。
CH3OH(g) △H<0,相关数据如图。
①该反应0~10min的平均速率υ(H2)___________mol/(L·min);M和N点的逆反应速率较大的是___________(填“υ逆(M)”、“υ逆(N)”或“不能确定”)。
②10min时容器内CO的体积分数为___________。
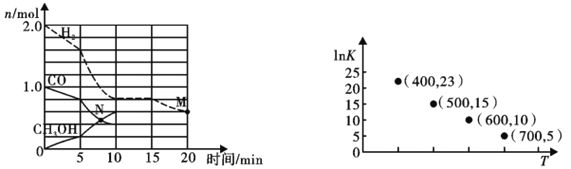
③对于气相反应,常用某组分(B)的平衡压强(PB)代替物质的量浓度(cB)表示平衡常数(以Kp表示),其中PB=P总×B的体积分数。若在TK下平衡气体总压强为xMPa,则该反应的平衡常数Kp=___________(写出表达式,不必化简)。实验测得不同温度下的lnKp(化学平衡常数Kp的自然对数)如图,请分析lnKp随T呈现上述变化趋势的原因______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com