
【题目】在密闭容器中,一定条件下进行如下反应2NO(g)+2CO(g)![]() N2(g)+2CO2(g),△H=-373.2kJ·mol-1,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是( )
N2(g)+2CO2(g),△H=-373.2kJ·mol-1,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是( )
A. 加催化剂同时升高温度 B. 加催化剂同时增大压强
C. 升高温度同时充入N2 D. 降低温度同时增大压强
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】实验室可用MnO2和浓盐酸反应制取氯气:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O。
MnCl2+Cl2↑+2H2O。
(1)用单线桥标出电子转移的方向和数目________________________。
(2)将上述化学方程式改写为离子方程式________________________。
(3)浓盐酸在反应中显示出来的性质是____________(填序号) 。
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(4)若产生2mol Cl2,则被氧化的HCl_____mol,转移的电子的数目为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是合成食品外包装材料聚乙烯的单体,可以由丁烷裂解制备。裂解的副反应为C4H10(g,正丁烷) ![]() CH4(g)+C3H6(g)
CH4(g)+C3H6(g)
请回答下列问题
(1)化学上,将稳定单质的能量定为0,由元素的单质化合成单一化合物时的反应热叫该化合物的生成热,生成热可表示该物质相对能量。25℃、101kPa几种有机物的生成热如下表所示:
物质 | 甲烷 | 乙烷 | 乙烯 | 丙烯 | 正丁烷 | 异丁烷 |
生成热/ kJ·mol-1 | -75 | -85 | 52 | 20 | -125 | -132 |
由正丁烷裂解生成乙烯的热化学方程式为_______________________________。
(2)一定温度下,在恒容密闭容器中投入一定量正丁烷发生反应生成乙烯。
①下列情况能说明该反应达到平衡状态的是__________(填标号)
A.气体密度保持不变 B.c(C2H4)·c(C2H6)/c(C4H10)保持不变
C.反应热保持不变 D.正丁烷分解速率利乙烷消耗速率相等
②为了提高反应速率和反应物的转化率,可采收的措施是______________________________。
(3)向密闭容器中充入正丁烷,在一定条件(浓度、催化剂及压强等)下发生反应,测得乙烯产率与温度关系如图所示。温度高于600℃时,随着温度升高,乙烯产率降低,可能的原因是____________________________________________。

(4)在一定温度下向10L恒容密闭容器中充入2mol正丁烷,反应生成乙烯和乙烷,经过10min达到平衡状态,测得平衡时气体压强是原来的1.75倍。
①0~10min内乙烷的生成速率v(C2H6)=__________ mol·L-1·min-1
②上述条件下,正丁烷的平衡转化率为______________,该反应的平衡常数K为____________。 (5)丁烷一空气燃料电池以熔融的K2CO3(其中不含O2-和HCO3-)为电解质,以具有催化作用和导电性能的稀土金属材料为电极。该燃料电池的正极反应式为26CO2+13O2+52e-=26CO32-,则负极反应式为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌-空气电池由活性炭(空气扩散极)、锌、苛性碱溶液构成,其中活性炭部分浸泡在苛性碱溶液中,其工作原理如图所示,负极产物是ZnO。下列说法正确的是( )

A. 活性炭的作用是吸附空气,为电池提供氧化剂
B. 原理图中的隔离膜为质子交换膜
C. 负极反应式为Zn+H2O-2e-=ZnO+2H+
D. 电池工作时,当电路中通过0.2mol电子,消耗3.2gO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由一种短周期金属元素和一种非金属元素组成的化合物X可与水发生复分解反应。某校兴趣小组用如图装置(夹持装置略去)对其进行探究实验。
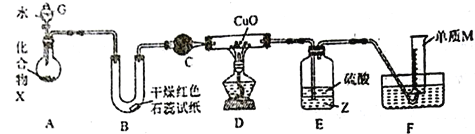
(1)仪器G的名称是_____________________,B中红色石蕊试纸变蓝,则单质M的电子式为___________________。
(2)化合物X中含组成单质M的元素质量分数为16.9%,写出X与水反应的化学方程式:_____________________________。
(3)C中的试剂名称为___________________________。
(4)实验时,装置D中硬质玻璃管内的现象为_________________________。
(5)裝置E中试剂Z为___________(填化学式),装置E的作用是_________________________。
(6)若不通过E、F两装置,请设计实验方案证明D中发生了反应(不通过观察D中固体颜色发生变化):__________________________________________________。
(7)若装置A中固体样品含有杂质(杂质不参与反应),某同学通过测定F中单质M在标准状况下的体积和固体样品的质量,以确定固体样品中X的质量分数,判断该方案是否可行,并说明原因:__________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出除去下列物质中杂质所选用的试剂及发生反应的离子方程式:
(1)盐酸(硫酸),试剂_________,离子方程式__________________________;
(2)NaOH(Na2CO3),试剂________,离子方程式___________ _________ ___;
(3)NaCl(CuCl2),试剂________,离子方程式_______________________ __。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学利用如图所示的实验装置进行铁与水蒸气的实验,并研究铁及其化合物的部分性质。

请回答下列问题:
(1)硬质试管中发生反应的化学方程式为______________________。
(2)该同学为确定反应后硬质试管中固体物质的成分,设计了如下实验方案:
①待硬质试管冷却后,取少许其中的固体物质溶于稀硫酸得溶液B;
②取少量溶液B滴加KSCN溶液,若溶液变红色,则说明硬质试管的固体物质中一定有____,可能有____;若溶液未变红色,则说明硬质试管中固体物质的成分是____________________。
(3)该同学按(2)中所述实验方案进行了实验,结果溶液未变红色,原因是___________(用离子方程式表示)。
(4)该同学马上另取少量溶液B,使其与NaOH溶液反应。若按下图所示操作,可观察到试管中先生成白色沉淀,后沉淀迅速变成灰绿色,最后变成红褐色的现象,请写出白色沉淀变为红褐色的过程中所发生反应的化学方程式:______________________________。

(5)一段时间后,该同学发现(3)中未变红的溶液变成红色,说明Fe2+具有____________性。由此可知,实验室中含有Fe2+的盐溶液需现用现配制的原因是____________________,并且配制含Fe2+的盐溶液时应加入少量____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com