
【题目】3H2O2 + 2H2CrO4 =2 Cr(OH)3 + 3O2 ↑+ 2H2O
(1)其中Cr被___________,H2O2作____________剂。
(2)_____________是氧化产物,_______________发生还原反应。
(3)反应转移了0.3mol电子,则产生的气体在标准状态下体积约为__________。
(4)用单线桥标明电子转移的方向和数目。_______
【答案】还原 还原 O2 H2CrO4 3.36L ![]()
【解析】
反应3H2O2+2H2CrO4=2Cr(OH)3+3O2+2H2O中,H2CrO4中Cr化合价从+6→+3,得电子,H2O2中O化合价从-1→0,失电子,结合氧化还原反应的规律分析解答。
(1)3H2O2+2H2CrO4═2Cr(OH)3+3O2↑+2H2O,反应中铬元素化合价从+6价变化为+3价,元素化合价降低,H2CrO4做氧化剂,被还原,发生还原反应;氧元素化合价-1价变化为0价,元素化合价升高,H2O2做还原剂,被氧化,发生氧化反应;故答案为:还原;还原;
(2)3H2O2+2H2CrO4═2Cr(OH)3+3O2↑+2H2O,反应中氧元素化合价-1价变化为0价,元素化合价升高,被氧化,氧化产物为O2;铬元素化合价从+6价变化为+3价,元素化合价降低,H2CrO4做氧化剂,被还原,发生还原反应,故答案为:O2;H2CrO4;
(3)3H2O2+2H2CrO4═2Cr(OH)3+3O2↑+2H2O反应中铬元素化合价从+6价变化为+3价;氧元素化合价-1价变化为0价,依据元素化合价变化,生成3mol氧气转移电子6mol,当反应转移0.3mol电子,则产生的氧气为0.15mol,在标准状态下的体积约为0.15mol×22.4L/mol=3.36L,故答案为:3.36L;
(4)Cr元素化合价从+6→+3,得电子,O元素化合价从-1→0,失电子,因此箭头由O指向Cr,转移的电子总数为:2×(6-3)=6,用单线桥法表示反应中电子转移的方向和数目为![]() ,故答案为:
,故答案为:![]() 。
。


 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案科目:高中化学 来源: 题型:
【题目】用下列装置完成相关实验,不合理的是( )

A. 用a趁热过滤提纯苯甲酸B. 用b制备并检验乙烯
C. 用c除去溴苯中的苯D. 用d分离硝基苯与水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表中评价合理的是( )
选项 | 化学反应及其离子方程式 | 评价 |
A | NaHSO4溶液与Ba(OH)2溶液反应至SO42-沉淀完全:2H++ SO42-+Ba2++2OH==BaSO4↓+2H2O | 正确 |
B | 向碳酸镁浊液中加入足量稀盐酸:CO32- +2H+ | 错误,碳酸镁不应写成离子形式 |
C | 向沸水中滴加饱和的氯化铁溶液至液体变为红褐色:Fe3++3H2O==Fe(OH)3↓+3H+ | 正确 |
D | 碳酸氢钠与足量澄清石灰水反应:2HCO3-+Ca2++2OH-==CaCO3↓+CO32-+2H2O | 正确 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨水、胆矾都是中学实验室中常见的化学试剂,它们在工农业生产上也都有广泛应用。某研究性学习小组为测定氨水的浓度,并用氨水作为提纯胆矾时的试剂,根据所查阅资料设计实验如下:
查阅资料:
①甲基橙的变色范围:pH<3.1红色,pH=3.1~4.4橙色, pH>4.4黄色
②酚酞的变色范围:pH<8.2无色 ,pH=8.2~10.0粉红色,pH>10.0红色
③已知:Fe3+、Fe2+、Cu2+转化为氢氧化物时相应的pH如下表:
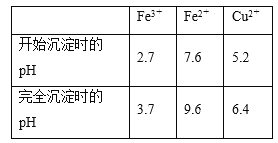
实验一 标定氨水的浓度
取25.00mL约为0.10 mol·L-1氨水于锥形瓶中,用0.1000 mol·L-1盐酸进行滴定,实验所得数据如下表所示:
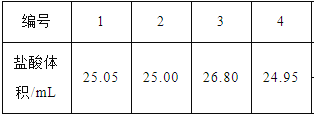
(1)滴定产物水解的离子方程式为____________________________________,由此可推知选择的滴定指示剂应为__________________。(填“甲基橙”或“酚酞”)
(2)该氨水的准确浓度为____________________mol·L-1。(精确到小数点后四位)
(3)编号3中溶液的离子浓度由大到小的顺序为__________________________________。
实验二 提纯胆矾晶体
某学习小组同学拟从含FeSO4、Fe2(SO4)3杂质的CuSO4溶液中提纯胆矾,其主要实验步骤如下:
第一步 往混合液中加入3% H2O2溶液充分反应后,再加入稀氨水调节溶液pH,过滤。
第二步 往滤液中加入稀硫酸调节溶液pH至1~2,提纯胆矾。
(4)加入3% H2O2溶液的作用是___________________________。
(5)加稀氨水调节pH应调至范围___________________________。
(6)下列物质可用来替代稀氨水的是___________________________。(填序号)
A.NaOH B.Cu(OH)2 C.CuO D.NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示装置和对应实验原理的描述均正确的是
A | B | C | D |
|
|
|
|
根据温度计读数的变化测定浓硫酸和NaOH溶液反应的反应热 | 加热固体NaHCO3制备少量的Na2CO3 | 验证牺牲阳极的阴极保护法,可证明铁被保护 | 根据小试管中液面的变化可判断铁钉发生了析氢腐蚀 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用0.1mol/LNaOH溶液分别滴定体积均为20mL,浓度均为0.1mol/LHCl溶液和HX溶液,溶液的pH随加入的NaOH溶液体积变化如图。下列说法正确的是
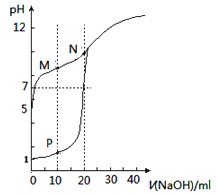
A. M点c(HX)-c(X-)>c(OH-)-c(H+)
B. N点的pH>7的原因是由于NaOH过量所致
C. HX为弱酸,且电离平衡常数Ka≈1×10-10
D. P点c(Cl-)=0.05mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列金属的冶炼方法中,属于热还原法的是( )
A. 2Ag2O![]() 4Ag+O2↑B. Fe+CuSO4===FeSO4+Cu
4Ag+O2↑B. Fe+CuSO4===FeSO4+Cu
C. Fe2O3+3CO![]() 2Fe+3CO2D. MgCl2(熔融)
2Fe+3CO2D. MgCl2(熔融) ![]() Mg+Cl2↑
Mg+Cl2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学反应原理研究碳、氮、硫的单质及其化合物的反应对缓解环境污染、能源危机具有重要意义。
I.氨为重要的化工原料,有广泛用途。
(1)合成氨中的氢气可由下列反应制取:
a. CH4(g)+H2O(g)CO(g)+3H2(g) H1=+216.4kJ/mol
b. CO(g)+H2O(g)CO2(g)+H2(g) H2=-41.2kJ/mol
则反应CH4(g)+2H2O(g)CO2(g)+4H2(g) H=___。
(2)起始时投入氮气和氢气的物质的量分别为1mol、3mol,在不同温度和压强下合成氨。平衡时混合物中氨的体积分数与温度的关系如图。
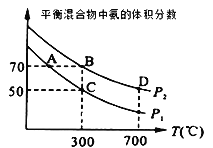
①恒压时,反应一定达到平衡状态的标志是___(填序号)
A. N2和H2的转化率相等 B. 反应体系密度保持不变
C. ![]() 保持不变 D.
保持不变 D. ![]() =2
=2
②P1___P2 (填“>”“=”或“<”,下同);反应的平衡常数:B点___D点。
③C点H2的转化率为__;
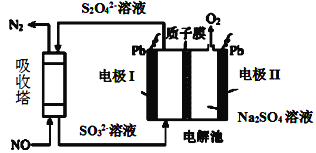
Ⅱ.用间接电化学法去除烟气中NO的原理如图所示。
(3)已知阴极室溶液呈酸性,则阴极的电极反应式为____。反应过程中通过质子膜的H+为2mol时,吸收塔中生成的气体在标准状况下的体积为____L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com