
【题目】下列图示装置和对应实验原理的描述均正确的是
A | B | C | D |
|
|
|
|
根据温度计读数的变化测定浓硫酸和NaOH溶液反应的反应热 | 加热固体NaHCO3制备少量的Na2CO3 | 验证牺牲阳极的阴极保护法,可证明铁被保护 | 根据小试管中液面的变化可判断铁钉发生了析氢腐蚀 |
A. AB. BC. CD. D
 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:
【题目】碳酸锂广泛应用于陶瓷和医药等领域,在水中的溶解度比较小。以锂辉石(主要成分为Li2O,含有少量SiO2、Al2O3、Fe2O3)为原料制备Li2CO3的流程如下:
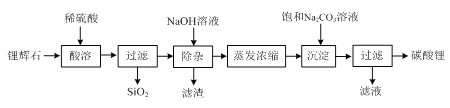
⑴ 写出“酸溶”时Li2O发生反应的离子方程式:________。
⑵ “除杂”时所用NaOH溶液不能过量,原因是________。
⑶ “除杂”时检验铁元素已完全除去的方法是________。
⑷ 写出“沉淀”时反应的化学方程式:________。
⑸ 检验最终所得碳酸锂样品中是否含有Na2CO3的方法是:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲配制0.2mol/L 的NaOH溶液980mL,有以下仪器:
①烧杯②漏斗③托盘天平(带砝码)④玻璃棒⑤胶头滴管
(1)配制时,必须使用的仪器有____________(填代号),还缺少的玻璃仪器是____________________。该实验中两次用到玻璃棒,其作用分别是____________________,____________________。
(2)使用容量瓶前必须进行的一步操作是_____________________。
(3)根据计算应用托盘天平称量NaOH_______g。
(4)请你分析下列哪些操作会引起所配浓度偏大________(填写字母)。
A.将NaOH放在滤纸上称量
B.称取NaOH的砝码已生锈
C.容量瓶未干燥即用来配制溶液
D.NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中,并进行定容;
E.往容量瓶转移时,有少量液体溅出
F.在容量瓶中定容时视线如图所示
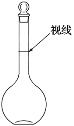
G.烧杯未进行洗涤
H.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线。
(5)若定容时不小心使液面超过了刻度线,应采取的措施是_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室要用NaCl固体配制100mL 2.0mol·L-1的NaCl溶液,试回答下列各题:
(1)下列仪器中,不会用到的是 _____________。
A.锥形瓶 B.100mL容量瓶 C.量筒 D.胶头滴管 E.50mL容量瓶 F.天平
(2)若要实施配制,除上述仪器外,尚缺的仪器或用品是___________________。
(3)容量瓶在使用前必须____________________________________。
(4)人们常将配制过程简述为以下各步骤:
A.冷却 B.称量 C.洗涤 D.定容 E.溶解 F.摇匀 G.转移
其正确的操作顺序应是_____________________________(填各步骤序号)。
(5)配制完毕后,教师指出有四位同学各进行了下列某一项错误操作,你认为这四项错误操作会导致所得溶液浓度偏高的是 (_________)
A.称量 NaCl固体时“左码右物”
B.定容时俯视容量瓶刻度线
C.将溶解冷却的溶液转入容量瓶后就直接转入定容操作
D.定容后,把容量瓶倒置摇匀后发现液面低于刻度线,便补充几滴水至刻度处
(6)通过计算可得出可用托盘天平称取NaCl固体质量是______________。若用5.0mol/L的NaCl溶液配制应用量筒量取________________mL该溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH<0,在一定温度和压强下于密闭容器中,反应达到平衡时,下列叙述正确的是
CO2(g)+H2(g) ΔH<0,在一定温度和压强下于密闭容器中,反应达到平衡时,下列叙述正确的是
A. 升高温度,K增大B. 减小压强,n(CO2)增大
C. 充入一定量的氮气,n(H2)不变D. 更换高效催化剂,CO的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】3H2O2 + 2H2CrO4 =2 Cr(OH)3 + 3O2 ↑+ 2H2O
(1)其中Cr被___________,H2O2作____________剂。
(2)_____________是氧化产物,_______________发生还原反应。
(3)反应转移了0.3mol电子,则产生的气体在标准状态下体积约为__________。
(4)用单线桥标明电子转移的方向和数目。_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全固态锂硫电池能量密度高、成本低,其工作原理如图所示,其电极a常用掺有石墨烯的S8材料,电极反应为:16Li+xS8=8Li2Sx(2≤x≤8)。下列说法正确的是
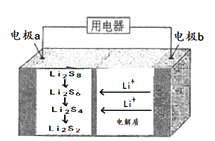
A. 电池工作时,外电路中流过0.02mol电子,负极材料减重0.14g
B. 电解池中加入少量硫酸增强导电性
C. 电池充电时间越长,电池中的Li2S2量越多
D. 电池工作时,负极可发生反应: 2Li2S6+2Li++2e-=3Li2S4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是
A. 钠与水反应:2Na +2H2O = 2Na++2OH-+H2↑
B. 氯气通入水中:Cl2 +H2O= 2H++ClO-+Cl-
C. 硫酸溶液与氢氧化钡溶液:H+ + SO42- + Ba2++ OH-=BaSO4↓ + H2O
D. Na2O 加入稀硫酸中:O2-+2H+ = H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,对于可逆反应X(g)+3Y(g)![]() 2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达平衡时,X、Y、Z的浓度分别为0.1 mol/L、0.3 mol/L、0.08 mol/L,则下列判断正确的是 ( )
2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达平衡时,X、Y、Z的浓度分别为0.1 mol/L、0.3 mol/L、0.08 mol/L,则下列判断正确的是 ( )
A. c1:c2=3∶1 B. 平衡时,Y和Z的生成速率之比为2∶3
C. X、Y的转化率不相等 D. c1的取值范围为0 mol/L<c1 <0.14 mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com