
【题目】碳酸锂广泛应用于陶瓷和医药等领域,在水中的溶解度比较小。以锂辉石(主要成分为Li2O,含有少量SiO2、Al2O3、Fe2O3)为原料制备Li2CO3的流程如下:
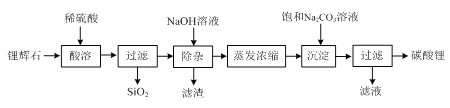
⑴ 写出“酸溶”时Li2O发生反应的离子方程式:________。
⑵ “除杂”时所用NaOH溶液不能过量,原因是________。
⑶ “除杂”时检验铁元素已完全除去的方法是________。
⑷ 写出“沉淀”时反应的化学方程式:________。
⑸ 检验最终所得碳酸锂样品中是否含有Na2CO3的方法是:________。
【答案】Li2O+2H+=2Li++H2O 若NaOH过量,Al(OH)3溶解生成NaAlO2 静置,取上层清液滴加KSCN溶液,溶液不显红色则铁元素已完全除去 Na2CO3+Li2SO4=Li2CO3↓+Na2SO4、 用洁净的铁丝(或铂丝)蘸取碳酸锂样品于酒精灯外焰上灼烧,若火焰呈黄色则含Na2CO3,反之则不含。
【解析】
锂辉石(主要成分为Li2O,含有少量SiO2、Al2O3、Fe2O3)加入稀硫酸,Li2O,Al2O3、Fe2O3转化为锂离子,铝离子,铁离子,SiO2与硫酸不反应,过滤后滤液中含有锂离子,铝离子,铁离子,加入氢氧化钠后,铝离子,铁离子分别生成氢氧化铝沉淀,氢氧化铁沉淀,过滤滤液中有锂离子,加入碳酸钠溶液产生碳酸锂沉淀。
(1)Li2O为碱性氧化物,与酸反应生成盐和水,发生反应的离子方程式:Li2O+2H+=2Li++H2O;
(2) “除杂”是为了将Fe3+和Al3+转化为Fe(OH)3和Al(OH)3除去,而Al(OH)3会溶于过量的碱,所用NaOH溶液不能过量,原因是氢氧化铝会与氢氧化钠反应生成偏铝酸钠,会引入新的杂质;
(3)“除杂”时检验铁元素已完全除去的方法是静置,取上层清液滴加KSCN溶液,溶液不显红色,则铁元素已完全除去;
(4)蒸发浓缩得到碳酸锂溶液,加入饱和的碳酸钠溶液发生的反应是Na2CO3+Li2SO4=Li2CO3↓+Na2SO4;
(5)碳酸锂中可能含有碳酸钠,检验的方法是焰色反应,具体是用洁净的铁丝(或铂丝)蘸取碳酸锂样品于酒精灯外焰上灼烧,若火焰呈黄色则含Na2CO3,反之则不含。


科目:高中化学 来源: 题型:
【题目】工业上可由乙苯生产苯乙烯:![]() ,下列说法正确的是
,下列说法正确的是
A. 该反应的类型为消去反应
B. 乙苯的同分异构体共有三种
C. 可用酸性高锰酸钾溶液鉴别乙苯和苯乙烯
D. 乙苯和苯乙烯分子内共平面的碳原子数均为7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为二氧化锰的有关转化关系图,下列有关说法中不正确的是( )
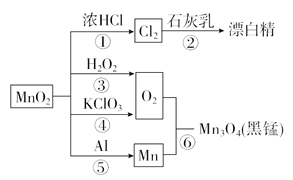
A. 反应①~⑥均属于氧化还原反应
B. 反应⑤中氧化剂与还原剂的物质的量之比为3∶4
C. 相同条件下生成等量的O2,反应③和④转移的电子数之比为1∶1
D. 反应①生成的Cl2经干燥后,可用钢瓶贮运
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用0.1 mol·Lˉ1 NaOH溶液分别滴定体积均为20mL、浓度均为0.1 mol·Lˉ1 HCl溶液和HX溶液,溶液的pH随加入NaOH溶液体积变化如图,下列说法不正确的是( )

A. HX为弱酸
B. M点c(HX)—c(X-)﹥c(OH-)—c(H+)
C. 将P点和N点的溶液混合,呈酸性
D. 向N点的溶液中通入HCl至pH=7:c(Na+) ﹥c(HX)=c(Cl-) >c(X-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】辉铜矿主要成分Cu2S,此外还含有少量SiO2、Fe2O3等杂质,软锰矿主要含有MnO2,以及少量SiO2、Fe2O3等杂质.研究人员开发综合利用这两种资源,用同槽酸浸湿法冶炼工艺,制备硫酸锰晶体和碱式碳酸铜。主要工艺流程如下:
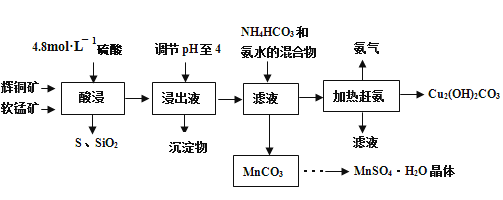
已知:
①MnO2有较强的氧化性,能将金属硫化物中的硫氧化为单质硫;
②[Cu(NH3)4]SO4常温稳定,在热水溶液中会分解生成NH3;
③部分金属阳离子生成氢氧化物沉淀的pH范围(开始沉淀和完全沉淀的pH):
Fe3+:1.5~3.2 Mn2+:8.3~9.8 Cu2+:4.4~6.4
④MnSO4·H2O溶于1份冷水、0.6份沸水,不溶于乙醇。
(1)实验室配制250mL 4.8molL-1的稀硫酸,所需的玻璃仪器除玻璃棒、量筒、烧杯以外还需要________________________。
(2)酸浸时,为了提高浸取率可采取的措施有_____________________(任写一点)。
(3)酸浸时,得到浸出液中主要含有CuSO4、MnSO4等。写出该反应的化学方程式:__________。
(4)调节浸出液pH=4的作用是______________。
(5)本工艺中可循环使用的物质是____________(写化学式)。
(6)获得的MnSO4H2O晶体需要进一步洗涤、干燥,洗涤时应用_____________洗涤。
(7)测定MnSO4H2O样品的纯度:准确称取样品14.00g,加蒸馏水配成100mL溶液,取出25.00mL用标准的BaCl2溶液测定,完全反应后得到了4.66g沉淀,则此样品的纯度为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列装置完成相关实验,不合理的是( )

A. 用a趁热过滤提纯苯甲酸B. 用b制备并检验乙烯
C. 用c除去溴苯中的苯D. 用d分离硝基苯与水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t ℃时,将一定量的混合气体在密闭容器中发生反应:aA(g)+bB(g) ![]() cC(g)+dD(g),平衡后测得B气体的浓度为0.6 mol·L-1。恒温下,将密闭容器的容积扩大1倍,重新达到平衡后,测得B气体的浓度为0.4 mol·L-1。下列叙述中正确的是
cC(g)+dD(g),平衡后测得B气体的浓度为0.6 mol·L-1。恒温下,将密闭容器的容积扩大1倍,重新达到平衡后,测得B气体的浓度为0.4 mol·L-1。下列叙述中正确的是
A. 重新达到平衡时,D的体积分数减小 B. a+b<c+d
C. 重新达到平衡时,A气体的浓度增大 D. 平衡向右移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无论是干重还是鲜重,组成水生动物、人体细胞的元素中含量最多的四种元素是
A.O、N、H、CaB.O、Ca、P、Mg
C.C、O、N、HD.C、Fe、Ca、P
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示装置和对应实验原理的描述均正确的是
A | B | C | D |
|
|
|
|
根据温度计读数的变化测定浓硫酸和NaOH溶液反应的反应热 | 加热固体NaHCO3制备少量的Na2CO3 | 验证牺牲阳极的阴极保护法,可证明铁被保护 | 根据小试管中液面的变化可判断铁钉发生了析氢腐蚀 |
A. AB. BC. CD. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com