
【题目】t ℃时,将一定量的混合气体在密闭容器中发生反应:aA(g)+bB(g) ![]() cC(g)+dD(g),平衡后测得B气体的浓度为0.6 mol·L-1。恒温下,将密闭容器的容积扩大1倍,重新达到平衡后,测得B气体的浓度为0.4 mol·L-1。下列叙述中正确的是
cC(g)+dD(g),平衡后测得B气体的浓度为0.6 mol·L-1。恒温下,将密闭容器的容积扩大1倍,重新达到平衡后,测得B气体的浓度为0.4 mol·L-1。下列叙述中正确的是
A. 重新达到平衡时,D的体积分数减小 B. a+b<c+d
C. 重新达到平衡时,A气体的浓度增大 D. 平衡向右移动
科目:高中化学 来源: 题型:
【题目】下列实验、现象、所对应的离子方程式不正确的是( )
选项 | 实验 | 现象 | 离子方程式 |
A | 将稀硫酸滴加到淀粉-KI溶液中 | 在空气中放置一段时间后溶液呈蓝色 | 4H++4I-+O2===2I2+2H2O |
B | 向FeBr2溶液中通入少量Cl2 | 溶液由浅绿色变棕黄色 | 2Fe2++Cl2===2Fe3++2Cl- |
C | 向氯水中加入适量NaOH溶液 | 溶液由黄绿色变为无色 | Cl2+2OH-===Cl-+ClO-+H2O |
D | 将Na2S加入到滴有酚酞的KCl溶液中 | 溶液由无色变为红色 | S2-+2H2O===H2S+2OH- |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图a酸性锌锰干电池是一种一次电池,外壳为金属锌,中间是碳棒,其周围是由碳粉,二氧化锰,氯化锌和氯化铵等组成的填充物,该电池在放电过程产生MnOOH,下列说法不正确的是
有关数据如下表所示:
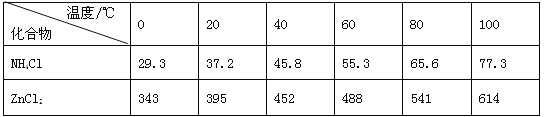
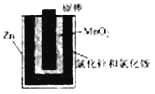
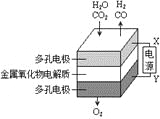
图a 图b
A. 该电池的正极反应式为MnO2+eˉ+H+==MnOOH
B. 利用干电池,高温电解H2O—CO2混合气体制备H2和CO,如图b,则阴、阳两极生成的气体的物质的量之比是1:1
C. 废电池糊状填充物加水处理后,过滤,滤液中主要有氯化锌和氯化铵,两者可以通过重结晶方法分离
D. 废电池糊状填充物加水处理后所得滤渣的主要成分是二氧化锰、碳粉和MnOOH,欲从中得到较纯的二氧化锰,可以采用加热的方法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸锂广泛应用于陶瓷和医药等领域,在水中的溶解度比较小。以锂辉石(主要成分为Li2O,含有少量SiO2、Al2O3、Fe2O3)为原料制备Li2CO3的流程如下:
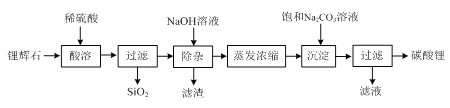
⑴ 写出“酸溶”时Li2O发生反应的离子方程式:________。
⑵ “除杂”时所用NaOH溶液不能过量,原因是________。
⑶ “除杂”时检验铁元素已完全除去的方法是________。
⑷ 写出“沉淀”时反应的化学方程式:________。
⑸ 检验最终所得碳酸锂样品中是否含有Na2CO3的方法是:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用分液漏斗向锥形瓶中滴加液体至过量,下列对锥形瓶中现象的预测符合实际情况的是
选项 | 锥形瓶 | 分液漏斗 | 预测现象 |
A | 酸性KMnO4溶液 | H2O2溶液 | 溶液紫红色逐渐褪去且产生大量气泡 |
B | Na2S溶液 | 久置氯水 | 生成淡黄色沉淀 |
C | Fe(OH)3胶体 | 盐酸 | 产生红褐色沉淀 |
D | Na2CO3溶液 | H2BO3溶液 | 产生大量气泡 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】火法炼铜是目前世界上最主要的冶炼铜的方法,其产量可占到铜总产量的85%以上,火法炼铜相关的方程式有
Cu2S(s)+O2(g)=2Cu(s)+SO2(g) △H1=-271.4kJ/mol 反应①
Cu2S(s)+2Cu2O(s)=6Cu(s)+SO2(g) △H2=+123.2kJ/mol 反应②
(1)Cu2S(s)在空气中煅烧生成Cu2O(s)和SO2(g)的热化学方程式是___。
(2)火法炼铜所得吹炼烟气中SO2含量较高,该烟气在工业上可直接用于生产硫酸,从绿色化学角度考虑其优点有____(任写一条)。
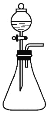
(3)在2L的恒温密闭容器中通入5mol氧气并加入足量Cu2S发生反应①(不考虑其它反应),容器中的起始压强为akPa,反应过程中某气体的体积分数随时间变化如图所示,反应前3min平均反应速率v(SO2)=___mol/(L·min),该温度下反应的平衡常数KP=___(KP为以分压表示的平衡常数)。若保持温度不变向平衡体系中再通入1mol氧气,达到新平衡后氧气的体积分数___(填“大于”“小于”或“等于”)原平衡时氧气的体积分数。
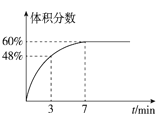
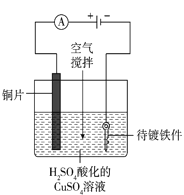
(4)工业上电镀铜的装置如图所示,阳极产物除Cu2+外还有部分Cu+,部分Cu+经过一系列变化会以Cu2O的形式沉积在镀件表面,导致镀层不够致密、光亮。电镀过程中用空气搅拌而不是氮气搅拌的原因是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,容器底部是培养基(含有植物生长所需的全部养分),如果有人在配制培养基的化学元素中使用了NH4NO3、KNO3、CaCl2、KH2PO4、铁溶液、微量元素溶液,但仍需补充缺少了的必需元素,应添加的化合物是

A.MgSO4B.MgCl2C.K2SO4D.Ca(NO3)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲配制0.2mol/L 的NaOH溶液980mL,有以下仪器:
①烧杯②漏斗③托盘天平(带砝码)④玻璃棒⑤胶头滴管
(1)配制时,必须使用的仪器有____________(填代号),还缺少的玻璃仪器是____________________。该实验中两次用到玻璃棒,其作用分别是____________________,____________________。
(2)使用容量瓶前必须进行的一步操作是_____________________。
(3)根据计算应用托盘天平称量NaOH_______g。
(4)请你分析下列哪些操作会引起所配浓度偏大________(填写字母)。
A.将NaOH放在滤纸上称量
B.称取NaOH的砝码已生锈
C.容量瓶未干燥即用来配制溶液
D.NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中,并进行定容;
E.往容量瓶转移时,有少量液体溅出
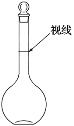
F.在容量瓶中定容时视线如图所示
G.烧杯未进行洗涤
H.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线。
(5)若定容时不小心使液面超过了刻度线,应采取的措施是_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全固态锂硫电池能量密度高、成本低,其工作原理如图所示,其电极a常用掺有石墨烯的S8材料,电极反应为:16Li+xS8=8Li2Sx(2≤x≤8)。下列说法正确的是
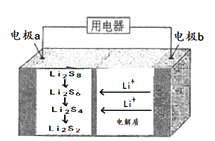
A. 电池工作时,外电路中流过0.02mol电子,负极材料减重0.14g
B. 电解池中加入少量硫酸增强导电性
C. 电池充电时间越长,电池中的Li2S2量越多
D. 电池工作时,负极可发生反应: 2Li2S6+2Li++2e-=3Li2S4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com