
【题目】火法炼铜是目前世界上最主要的冶炼铜的方法,其产量可占到铜总产量的85%以上,火法炼铜相关的方程式有
Cu2S(s)+O2(g)=2Cu(s)+SO2(g) △H1=-271.4kJ/mol 反应①
Cu2S(s)+2Cu2O(s)=6Cu(s)+SO2(g) △H2=+123.2kJ/mol 反应②
(1)Cu2S(s)在空气中煅烧生成Cu2O(s)和SO2(g)的热化学方程式是___。
(2)火法炼铜所得吹炼烟气中SO2含量较高,该烟气在工业上可直接用于生产硫酸,从绿色化学角度考虑其优点有____(任写一条)。
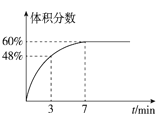
(3)在2L的恒温密闭容器中通入5mol氧气并加入足量Cu2S发生反应①(不考虑其它反应),容器中的起始压强为akPa,反应过程中某气体的体积分数随时间变化如图所示,反应前3min平均反应速率v(SO2)=___mol/(L·min),该温度下反应的平衡常数KP=___(KP为以分压表示的平衡常数)。若保持温度不变向平衡体系中再通入1mol氧气,达到新平衡后氧气的体积分数___(填“大于”“小于”或“等于”)原平衡时氧气的体积分数。
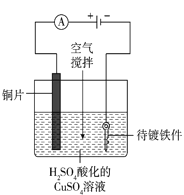
(4)工业上电镀铜的装置如图所示,阳极产物除Cu2+外还有部分Cu+,部分Cu+经过一系列变化会以Cu2O的形式沉积在镀件表面,导致镀层不够致密、光亮。电镀过程中用空气搅拌而不是氮气搅拌的原因是_____。
【答案】2Cu2S(s)+3O2(g)=2Cu2O(s)+2SO2(g) △H=-937.4kJ/mol 可减少污染物排放或者原子利用率高 0.4 1.5 等于 氧气可将Cu+氧化为Cu2+以防止镀件表面生成Cu2O
【解析】
(1)根据盖斯定律,2Cu2S(s)+3O2(g)=2Cu2O(s)+2SO2(g)为反应①×3-反应②所得,因此△H=3△H1-△H2=-937.4kJ/mol
答案为:2Cu2S(s)+3O2(g)=2Cu2O(s)+2SO2(g) △H=-937.4kJ/mol
(2)吹炼烟气用于生产硫酸可减少SO2的排放;用该烟气生产硫酸的反应为![]()
![]()
![]() 和SO3+H2O=H2SO4,两个反应的原子利用率均为100%。
和SO3+H2O=H2SO4,两个反应的原子利用率均为100%。
答案为:可减少污染物排放或者原子利用率高;
(3)反应①中气体总物质的量始终为5mol,3min时SO2体积分数为48%,c(SO2)=![]() =1.2mol/L,因此v(SO2)=
=1.2mol/L,因此v(SO2)=![]() =0.4mol/(L·min)。体系达平衡时总压强为akPa,O2和SO2的分压分别为0.4akPa和06akPa,KP=
=0.4mol/(L·min)。体系达平衡时总压强为akPa,O2和SO2的分压分别为0.4akPa和06akPa,KP=![]() ,原平衡时氧气的体积分数为40%,根据平衡常数表达式
,原平衡时氧气的体积分数为40%,根据平衡常数表达式![]() ,温度不变,平衡常数不变,增加气体用量,平衡时SO2与O2的物质的量浓度之比保持不变,因此达到新平衡后氧气的体积分数仍为40%。
,温度不变,平衡常数不变,增加气体用量,平衡时SO2与O2的物质的量浓度之比保持不变,因此达到新平衡后氧气的体积分数仍为40%。
答案为:0.4;1.5;等于
(4)阳极产物除Cu2+外还有部分Cu+,部分Cu+经过一系列变化会以Cu2O的形式沉积在镀件表面,导致镀层不够致密、光亮。通入空气可利用氧气将Cu+氧化为Cu2+,可有效预防镀件表面生成Cu2O;
答案为:氧气可将Cu+氧化为Cu2+以防止镀件表面生成Cu2O;


科目:高中化学 来源: 题型:
【题目】已知NaNO2是色泽和味道与NaCl相似的盐,是导致某些建筑工地食物中毒的主要物质,它可与酸性KMnO4溶液发生反应2MnO![]() +5NO
+5NO![]() +a===b+5
+a===b+5![]() +3H2O。下列叙述正确的是( )
+3H2O。下列叙述正确的是( )
A. a是6H+,b是2MnO2
B. 反应过程中溶液的pH减小
C. 还原产物是Mn2+
D. 当有0.1 mol b生成时转移电子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用0.1 mol·Lˉ1 NaOH溶液分别滴定体积均为20mL、浓度均为0.1 mol·Lˉ1 HCl溶液和HX溶液,溶液的pH随加入NaOH溶液体积变化如图,下列说法不正确的是( )

A. HX为弱酸
B. M点c(HX)—c(X-)﹥c(OH-)—c(H+)
C. 将P点和N点的溶液混合,呈酸性
D. 向N点的溶液中通入HCl至pH=7:c(Na+) ﹥c(HX)=c(Cl-) >c(X-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列装置完成相关实验,不合理的是( )

A. 用a趁热过滤提纯苯甲酸B. 用b制备并检验乙烯
C. 用c除去溴苯中的苯D. 用d分离硝基苯与水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t ℃时,将一定量的混合气体在密闭容器中发生反应:aA(g)+bB(g) ![]() cC(g)+dD(g),平衡后测得B气体的浓度为0.6 mol·L-1。恒温下,将密闭容器的容积扩大1倍,重新达到平衡后,测得B气体的浓度为0.4 mol·L-1。下列叙述中正确的是
cC(g)+dD(g),平衡后测得B气体的浓度为0.6 mol·L-1。恒温下,将密闭容器的容积扩大1倍,重新达到平衡后,测得B气体的浓度为0.4 mol·L-1。下列叙述中正确的是
A. 重新达到平衡时,D的体积分数减小 B. a+b<c+d
C. 重新达到平衡时,A气体的浓度增大 D. 平衡向右移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.质量数是将原子核内所有的质子和中子的相对质量取整数值之和
B.![]() X表示一种X元素的一种原子,中子数为A-Z
X表示一种X元素的一种原子,中子数为A-Z
C.![]() X中,A为该原子的相对原子质量的近似值
X中,A为该原子的相对原子质量的近似值
D.原子都是质子和中子、电子组成,原子不带电
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无论是干重还是鲜重,组成水生动物、人体细胞的元素中含量最多的四种元素是
A.O、N、H、CaB.O、Ca、P、Mg
C.C、O、N、HD.C、Fe、Ca、P
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表中评价合理的是( )
选项 | 化学反应及其离子方程式 | 评价 |
A | NaHSO4溶液与Ba(OH)2溶液反应至SO42-沉淀完全:2H++ SO42-+Ba2++2OH==BaSO4↓+2H2O | 正确 |
B | 向碳酸镁浊液中加入足量稀盐酸:CO32- +2H+ | 错误,碳酸镁不应写成离子形式 |
C | 向沸水中滴加饱和的氯化铁溶液至液体变为红褐色:Fe3++3H2O==Fe(OH)3↓+3H+ | 正确 |
D | 碳酸氢钠与足量澄清石灰水反应:2HCO3-+Ca2++2OH-==CaCO3↓+CO32-+2H2O | 正确 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用0.1mol/LNaOH溶液分别滴定体积均为20mL,浓度均为0.1mol/LHCl溶液和HX溶液,溶液的pH随加入的NaOH溶液体积变化如图。下列说法正确的是
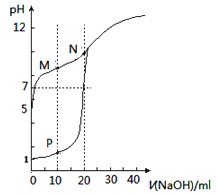
A. M点c(HX)-c(X-)>c(OH-)-c(H+)
B. N点的pH>7的原因是由于NaOH过量所致
C. HX为弱酸,且电离平衡常数Ka≈1×10-10
D. P点c(Cl-)=0.05mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com