
| A、NaHCO3+NaHS→Na2CO3+H2S↑ |
| B、H2S+Na2CO3→NaHS+NaHCO3 |
| C、Na2S+H2O+CO2→Na2CO3+H2S↑ |
| D、H2S+NaHCO3→NaHS+H2CO3 |


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
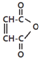 是一种有机试剂和有机合成原料,是丁烯二酸的酸酐.欲由1,3-丁二烯为原料制取丁烯二酸(HOOCCH=CHCOOH),设计如下四种路径(其中“氧化”指用强氧化剂将醇羟基氧化为羧基).
是一种有机试剂和有机合成原料,是丁烯二酸的酸酐.欲由1,3-丁二烯为原料制取丁烯二酸(HOOCCH=CHCOOH),设计如下四种路径(其中“氧化”指用强氧化剂将醇羟基氧化为羧基).查看答案和解析>>
科目:高中化学 来源: 题型:
 我校环保兴趣小组在处理污水样品时,需用质量分数为37%的浓盐酸(密度为1.19g/cm3)配制成250mL 0.1mol?L-1的盐酸溶液.
我校环保兴趣小组在处理污水样品时,需用质量分数为37%的浓盐酸(密度为1.19g/cm3)配制成250mL 0.1mol?L-1的盐酸溶液.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、O4是氧元素的一种同位素 |
| B、O4可能含有极性键 |
| C、同温同压下,等体积的O4气体和O2含有相同的分子数 |
| D、O4转化O2为物理变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe2+、Cl-、SO42-、Na+ |
| B、NH4+、Al3+、NO3-、Cl- |
| C、Ca2+、K+、Cl-、HCO3- |
| D、K+、Na+、SO32-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | 实验操作 | 实验目的 |
| A | 取少量溶液滴加Ca(OH)2溶液,观察是否出现白色浑浊 | 确定NaHCO3溶液中是否混有Na2CO3 |
| B | 向盛有1mL硝酸银溶液的试管中滴加NaCl溶液,至不再有沉淀生成,再向其中滴加Na2S溶液 | 说明一种沉淀能转化为另一种溶解度更小的沉淀 |
| C | 测定等浓度的HCl、HNO3两溶液的pH | 比较氯、N的非金属性强弱 |
| D | 将充满NO2的密闭玻璃球浸泡在热水中 | 研究温度对化学平衡移动的影响 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②⑥ | B、①③④ |
| C、②③⑤ | D、④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、v(O2)=3.2g?L-1?min-1 |
| B、v(O2)=0.1 mol?L-1?min-1 |
| C、v(KCl)=0.1 mol?L-1?min-1 |
| D、v(KClO3)=0.0667 mol?L-1?min-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com