
【题目】烃A的产量能衡量一个国家石油化工发展水平,F的碳原子数为D的两倍,以A为原料合成F,其合成路线如图所示:
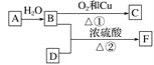
(1)写出决定B、D性质的重要原子团的名称:
B________、D________。
(2)A的结构式为____________。
(3)写出下列反应的化学方程式并注明反应类型:
①______________________,反应类型:_______;
②_________________,反应类型:________。
(4)实验室怎样区分B和D?___________。
(5)除去F中少量B和D的最好试剂是________(填字母)。
A 饱和碳酸钠溶液 B 氢氧化钠溶液 C 苯 D 水
【答案】羟基 羧基 ![]() 2CH3CH2OH+O2
2CH3CH2OH+O2![]() 2CH3CHO+2H2O 氧化反应 CH3COOH+CH3CH2OH
2CH3CHO+2H2O 氧化反应 CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O 酯化反应(或取代反应) 分别取少量待测液于试管中,滴加少量石蕊溶液,若溶液变红,则所取待测液为乙酸,另一种为乙醇(答案合理均可) A
CH3COOCH2CH3+H2O 酯化反应(或取代反应) 分别取少量待测液于试管中,滴加少量石蕊溶液,若溶液变红,则所取待测液为乙酸,另一种为乙醇(答案合理均可) A
【解析】
根据A的产量通常用来衡量一个国家的石油化工水平,判断A应为乙烯,结构式为![]() ,乙烯和水在催化剂条件下发生加成反应生成乙醇,所以B为乙醇,乙醇被催化氧化生成乙醛,所以C为乙醛;F的碳原子数为D的两倍,根据反应条件可知D为乙酸,乙醇和乙酸在浓硫酸作用下反应生成乙酸乙酯,所以F为乙酸乙酯,据此进行解答。
,乙烯和水在催化剂条件下发生加成反应生成乙醇,所以B为乙醇,乙醇被催化氧化生成乙醛,所以C为乙醛;F的碳原子数为D的两倍,根据反应条件可知D为乙酸,乙醇和乙酸在浓硫酸作用下反应生成乙酸乙酯,所以F为乙酸乙酯,据此进行解答。
(1)根据上述分析可知:B为乙醇,D为乙酸,决定B、D性质的重要原子团的名称:B羟基、D羧基。答案:羟基; 羧基。
(2)由分析知A为乙烯,其结构式为![]() 。答案:
。答案:![]() 。
。
(3)由图可知①发生的是CH3CH2OH 催化氧化为CH3CHO 的反应,反应方程式为2CH3CH2OH+O2![]() 2CH3CHO+2H2O 答案:2CH3CH2OH+O2
2CH3CHO+2H2O 答案:2CH3CH2OH+O2![]() 2CH3CHO+2H2O ; 氧化反应。
2CH3CHO+2H2O ; 氧化反应。
②发生的是乙醇和乙酸在浓硫酸作用下反应生成乙酸乙酯CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O ,反应类型为酯化反应(或取代反应);答案:CH3COOH+CH3CH2OH
CH3COOCH2CH3+H2O ,反应类型为酯化反应(或取代反应);答案:CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O ;酯化反应(或取代反应)。
CH3COOCH2CH3+H2O ;酯化反应(或取代反应)。
(4)由B为乙醇,D为乙酸,实验室可以通过:分别取少量待测液于试管中,滴加少量石蕊溶液,若溶液变红,则所取待测液为乙酸,另一种为乙醇的方法区分;答案:分别取少量待测液于试管中,滴加少量石蕊溶液,若溶液变红,则所取待测液为乙酸,另一种为乙醇,其他答案符合题意也可。
(5)F为乙酸乙酯,B为乙醇,D为乙酸,除去F中少量B和D的最好试剂是饱和碳酸钠溶液,可以吸收乙酸,溶解乙醇,降低乙酸乙酯的溶解性。答案:A。


 学业测评一课一测系列答案
学业测评一课一测系列答案科目:高中化学 来源: 题型:
【题目】部分弱酸的电离常数如下表:

下列有关说法正确的是( )
A. 恰好中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者大于后者
B. 等体积、等浓度的HCOONa和NaCN两溶液中所含离子总数目HCOONa大于NaCN
C. NaHS溶液中加入适量 KOH后:c(Na+)=c(H2S)+c(HS-)+2c(S2-)
D. HCOO-、CN-、HS-在溶液中不可以大量共存
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种物质是含钠元素的单质或化合物,其中B为淡黄色固体,它们有如图所示的转化关系:
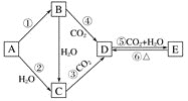
(1)推断各符号所代表的物质的化学式:
A____________,B____________,C____________,D____________,E____________。
(2)分别写出反应②、⑤的化学方程式:
②______________________________________,
⑤__________________________________________。
(3)写出反应③的离子方程式____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家在天然气脱硫研究方面取得了新进展,利用如图装置可发生反应:H2S+O2=H2O2+S,已知甲池中发生的反应:


下列说法正确的是( )
A. 甲池中碳棒上发生的电极反应为AQ+2H+-2e-=H2AQ
B. 乙池溶液中发生的反应为H2S+I3-=3I-+S+2H+
C. 该装置中电能转化为光能
D. H+从甲池移向乙池
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,pH简单计算。
(1)0.05mol/L的硫酸溶液的pH=________________;0,01mol/L的NaOH溶液的pH=________________。
(2)1mlpH=2的硫酸加水稀释至100ml,pH=___________。
(3)常温下,由水电离出的C(H+)=1×10-12mol/L,则,该溶液的可能pH=___________。
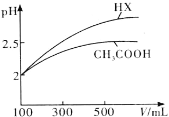
(4)体积均为100mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数________(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数。
(5)常温下,常温下,pH=12的NaOH溶液与pH=1的HCl溶液按一定比例混合,所得溶液pH=2,则NaOH溶液与HCl溶液的体积比为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢卤酸的能量关系如图所示下列说法正确的是

A. 已知HF气体溶于水放热,则HF的△H1<0
B. 相同条件下,HCl的△H2比HBr的小
C. 相同条件下,HCl的△H3+△H4比HI的大
D. 一定条件下,气态原子生成1molH-X键放出akJ能量,则该条件下△H2=+akJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向一定体积 0.1mol/L 醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH (pOH = -lg[OH-])与pH的变化关系如图所示,则

A. M点所示溶液导电能力强于Q点
B. N点所示溶液中c(CH3COO-)﹥c(Na+)
C. M点和N点所示溶液中水的电离程度相同
D. Q点消耗NaOH溶液的体积等于醋酸溶液的体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,下列反应中水蒸气含量随反应时间的变化趋势符合下图的是( )
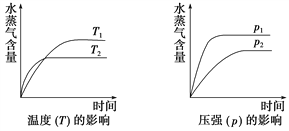
A. CO2(g)+H2(g) ![]() CO(g)+H2O(g) ΔH>0
CO(g)+H2O(g) ΔH>0
B. CH3CH2OH(g )![]() CH2===CH2(g)+H2O(g) ΔH>0
CH2===CH2(g)+H2O(g) ΔH>0
C. 2C6H5CH2CH3(g)+O2(g) ![]() 2C6H5CH===CH2(g)+2H2O(g) ΔH<0
2C6H5CH===CH2(g)+2H2O(g) ΔH<0
D. CO2(g)+2NH3(g) ![]() CO(NH2)2(s)+H2O(g) ΔH<0
CO(NH2)2(s)+H2O(g) ΔH<0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com