
【题目】部分弱酸的电离常数如下表:

下列有关说法正确的是( )
A. 恰好中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者大于后者
B. 等体积、等浓度的HCOONa和NaCN两溶液中所含离子总数目HCOONa大于NaCN
C. NaHS溶液中加入适量 KOH后:c(Na+)=c(H2S)+c(HS-)+2c(S2-)
D. HCOO-、CN-、HS-在溶液中不可以大量共存
【答案】B
【解析】
A.根据电离平衡常数,HCOOH的酸性强于HCN,等pH等体积时,c(HCN)>c(HCOOH),HCOOH消耗NaOH的体积小于HCN,即恰好中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者,故A错误;
B.根据电荷守恒,HCOONa溶液中:c(HCOO-)+c(OH-)=c(Na+)+c(H+),NaCN溶液中:c(CN-)+c(OH-)=c(Na+)+c(H+),即离子总数是n(Na+)+n(H+)的2倍,而NaCN的水解程度大,即NaCN溶液中c(OH-)大,c(H+)小,c(Na+)相同,所以甲酸钠中离子总数大,故B正确;
C.NaHS溶液中加入适量KOH后反应生成硫化钾和硫化钠,根据溶液中物料守恒有c(Na+)=c(S2-)+c(HS-)+c(H2S),故C错误;
D.根据电离平衡常数,电离出H+能力:HCOOH>H2S>HCN>HS-,离子之间不发生反应,因此这些离子能够大量共存,故D错误。
故选B。


科目:高中化学 来源: 题型:
【题目】我国古代“药金”的冶炼方法是:将炉甘石(ZnCO3)和赤铜矿(Cu2O)与木炭按一定的比例混合后加热至800℃,即可炼出闪烁似金子般光泽的“药金”。下列叙述正确的是( )
A. “药金”实质上是铜锌合金
B. 冶炼炉中炉甘石直接被木炭还原为锌
C. 用王水可区别黄金和“药金”
D. 用火焰灼烧不能区别黄金和药金
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2020年1月10日,国家自然科学奖一等奖授予中国科学院院士周其林教授领导团队历时20年科研攻关完成的重要科研成果“高效手性螺环催化剂的发现”。关于催化剂说法正确的是
A.可以改变反应速率B.可以改变反应热(ΔH)
C.可以改变反应转化率D.可以改变反应平衡常数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是苯和溴的取代反应的实验装置图,其中 A 为具有支管的试管改制成的反应容器,在其下端开了一个小孔,塞好石棉绒,再加入少量的铁屑粉。填写下列空白:

(1)向反应容器A 中逐滴加入溴和苯的混合液,几秒钟内就发生反应。写出A 中发生反应的化学方程式(有机物写结构简式)____;
(2)能证明A 中发生的是取代反应,而不是加成反应,试管C 中苯的作用是__________。反应开始后,观察D 和E 两支试管,看到的现象分别是___________,________;
(3)反应 2 min~3 min 后,在 B 中的氢氧化钠溶液里可观察到的现象是______、_____;
(4)苯是一种重要的化工原料,以下是用苯作为原料制备某些化合物的转化关系图:

已知:a.RNO2 ![]() RNH2
RNH2
b.苯环上原有的取代基对新导入的取代基进入苯环的位置有显著影响。
c.![]() +H2SO4(浓)
+H2SO4(浓)![]()
 +H2O
+H2O
①A 转化为 B 的化学方程式是________;
②E 的结构简式为__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下[已知N2(g)十3H2(g)![]() 2NH3(g) △H=-92.4kJ/mol];下列说法正确的是( )
2NH3(g) △H=-92.4kJ/mol];下列说法正确的是( )
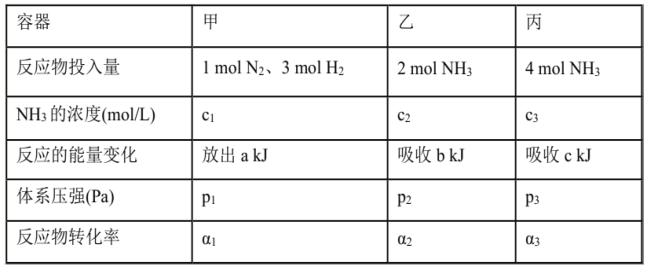
A. 2c1>c3 B. a+b>92.4 C. 2p2<p3 D. α1+α3<1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.通常,同周期元素的第一电离能ⅦA族的元素最大
B.主族元素的原子形成单原子离子时的化合价数都和它的族序数相等
C.第ⅠA、ⅡA族元素的原子,其半径越大,第一电离能越大
D.在同一主族中,自上而下第一电离能逐渐减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一块表面被氧化的钠,投入足量水中充分反应,放出3.36L(标准状况)的气体,该气体在电火花下刚好完全反应;测得反应后溶液的体积为200mL,此溶液与100mL6mol/L的盐酸恰好完全中和。试计算(简要写出计算过程):
(1)反应所得NaOH溶液的物质的量浓度是多少______?
(2)该表面被氧化的钠各成分的质量是多少g______?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L密闭容器内,800 ℃时反应2NO(g)+O2(g) ![]() 2NO2(g)体系中,n(NO)随时间的变化见下表:
2NO2(g)体系中,n(NO)随时间的变化见下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.02 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |

(1)如图表示NO2的浓度变化的曲线是______________________。用O2表示从0~2 s内该反应的平均速率v=____________________。
(2)能说明该反应已达到平衡状态的是______________________。
A.v(NO2)=2v(O2) B.容器内压强保持不变
C.v逆(NO)=2v正(O2) D.容器内密度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烃A的产量能衡量一个国家石油化工发展水平,F的碳原子数为D的两倍,以A为原料合成F,其合成路线如图所示:
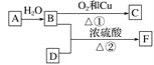
(1)写出决定B、D性质的重要原子团的名称:
B________、D________。
(2)A的结构式为____________。
(3)写出下列反应的化学方程式并注明反应类型:
①______________________,反应类型:_______;
②_________________,反应类型:________。
(4)实验室怎样区分B和D?___________。
(5)除去F中少量B和D的最好试剂是________(填字母)。
A 饱和碳酸钠溶液 B 氢氧化钠溶液 C 苯 D 水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com