
����Ŀ����O2��HClת��ΪCl2 �� �����Ч�棬������Ⱦ��
��1����ͳ�ϸ�ת��ͨ����ͼ1��ʾ�Ĵ�ѭ��ʵ�֣����У���Ӧ��Ϊ��2HCl��g��+CuO��s��H2O��g��+CuCl2��s����H1 �� ��Ӧ������1molCl2��g���ķ�Ӧ��Ϊ��H2 �� ���ܷ�Ӧ���Ȼ�ѧ����ʽΪ����Ӧ���á�H1�͡�H2��ʾ���� 
��2������RuO2����������HClת��ΪCl2���ܷ�Ӧ���и��õĴ����ԣ� ��ʵ������һ��ѹǿ�£��ܷ�Ӧ��HClƽ��ת�������¶ȱ仯�Ħ�HCl��T������ͼ2�����ܷ�Ӧ�ġ�H0�����������=����������A��B�����ƽ�ⳣ��K��A����K��B���нϴ���� ��
��������ʵ������ѹ�����ʹѹǿ��������Ӧ��HCl��T���ߵ�ʾ��ͼ������Ҫ˵�����ɣ�
�����д�ʩ�У���������ߦ�HCl���� ��
A������n��HCl�� B������n��O2��
C��ʹ�ø��õĴ��� D����ȥH2O
��3��һ�������²�÷�Ӧ������n��Cl2�����������£�
t/min | 0 | 2.0 | 4.0 | 6.0 | 8.0 |
n��Cl2��/10��3mol | 0 | 1.8 | 3.7 | 5.4 | 7.2 |
����2.0��6.0min����HCl�����ʵ����仯��ʾ�ķ�Ӧ���ʣ���molmin��1Ϊ��λ��д��������̣���
��4��Cl2��;�㷺��д����Cl2�Ʊ�Ư�۵Ļ�ѧ��Ӧ����ʽ ��
���𰸡�
��1��4HCl��g��+O2��g��=2Cl2��g��+2H2O��g����H=2����H1+��H2��
��2������ K��A���� 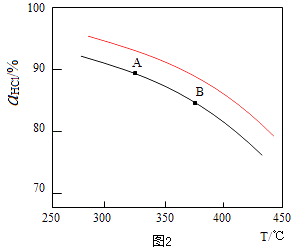 ����ѹǿ,ƽ��������Ӧ�����ƶ�,��HCl����,��ͬ�¶���HCl��ƽ��ת���ʱ�֮ǰʵ��Ĵ� BD
����ѹǿ,ƽ��������Ӧ�����ƶ�,��HCl����,��ͬ�¶���HCl��ƽ��ת���ʱ�֮ǰʵ��Ĵ� BD
��3���⣺�ɱ������ݿ�֪��2.0��6.0min�ڡ�n��Cl2��=��5.4��1.8����10��3mol=3.6��10��3mol������Cl2�����ʵ����仯��ʾ�ķ�Ӧ����v��Cl2��= ![]() =9��10��4molmin��1������֮�ȵ����仯ѧ������֮�ȣ���v��HCl��=2v��Cl2��=1.8��10��3mol��min��1��
=9��10��4molmin��1������֮�ȵ����仯ѧ������֮�ȣ���v��HCl��=2v��Cl2��=1.8��10��3mol��min��1��
��2.0��6.0min����HCl�����ʵ����仯��ʾ�ķ�Ӧ����1.8��10��3molmin��1
��4��2Cl2+2Ca��OH��2=CaCl2+Ca��ClO��2+2H2O
���������⣺��1����ͼʾ��֪����������Ϊ��4HCl+O2=2Cl2+2H2O����Ӧ��Ϊ��2HCl��g��+CuO��s��H2O��g��+CuCl2��s����H1��
��Ӧ������1molCl2��g���ķ�Ӧ��Ϊ��H2����Ӧ�Ȼ�ѧ����ʽΪ��CuCl2��g��+ ![]() O2��g��=CuO��s��+Cl2��g����H2��
O2��g��=CuO��s��+Cl2��g����H2��
���ݸ�˹���ɣ���+�ڣ���2�ɵ��ܷ�Ӧ���Ȼ�ѧ����ʽ��4HCl��g��+O2��g��=2Cl2��g��+2H2O��g����H=2����H1+��H2����
���Դ��ǣ�4HCl��g��+O2��g��=2Cl2��g��+2H2O��g����H=2����H1+��H2������2����ͼ��֪���¶�Խ�ߣ�ƽ��ʱHCl��ת����ԽС��˵�������¶�ƽ�����淴Ӧ�����ƶ���������ӦΪ���ȷ�Ӧ������H��0����ѧƽ�ⳣ����С����K��A����K��B����
���Դ��ǣ�����K��A����������ӦΪ���������С�ķ�Ӧ������ѹǿ��ƽ��������Ӧ�����ƶ�����ͬ�¶���HCl��ƽ��ת���ʱ�֮ǰʵ��Ĵ�ѹ�����ʹѹǿ������Ӧ��HCl��T���ߵ�ʾ��ͼΪ  ��
��
���Դ��ǣ� 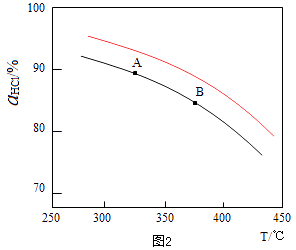 ������ѹǿ��ƽ��������Ӧ�����ƶ�����HCl������ͬ�¶���HCl��ƽ��ת���ʱ�֮ǰʵ��Ĵ�A������n��HCl����HClŨ������ƽ�����ƣ���HCl��ת���ʽ��ͣ���A����
������ѹǿ��ƽ��������Ӧ�����ƶ�����HCl������ͬ�¶���HCl��ƽ��ת���ʱ�֮ǰʵ��Ĵ�A������n��HCl����HClŨ������ƽ�����ƣ���HCl��ת���ʽ��ͣ���A����
B������n��O2��������Ũ������ƽ�����ƣ�HCl��ת������ߣ���B��ȷ��
C��ʹ�ø��õĴ������ӿ췴Ӧ���ʣ����̵���ƽ���ʱ�䣬��Ӱ��ƽ���ƶ���HCl��ת���ʲ��䣬��C����
D����ȥ������H2O��������ƽ�����ƣ�HCl��ת��������D��ȷ��
��ѡ��BD����4���������������Ʒ�Ӧ�����Ȼ��ơ����������ˮ����Ӧ����ʽΪ2Cl2+2Ca��OH��2=CaCl2+Ca��ClO��2+2H2O��
���Դ��ǣ�2Cl2+2Ca��OH��2=CaCl2+Ca��ClO��2+2H2O��
�����㾫�������ջ�ѧƽ��״̬���ʼ������ǽ����ĸ�������Ҫ֪����ѧƽ��״̬�����������ȡ��� V��=V��>0�����������Ƕ�̬ƽ�⣬ƽ��ʱ��Ӧ���ڽ��У�����������Ӧ������и���ְٷֺ������䣻���䡱�������ı䣬ƽ�ⱻ���ƣ������µ������½����µĻ�ѧƽ�⣻��;���أ�����������䣬���淴Ӧ�����Ǵ�����Ӧ��ʼ�����Ǵ��淴Ӧ��ʼ�����ɽ���ͬһƽ��״̬����Ч����


 һ��һ����ʱ���ϵ�д�
һ��һ����ʱ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij���Ľṹ��ʽΪ�� 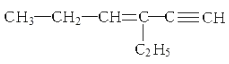 ������˵������ȷ���ǣ� ��
������˵������ȷ���ǣ� ��
A.1mol������ȫȼ������11mol O2
B.��������ȫ�ӳɺ�IJ����к�3����
C.1mol������ȫ�ӳ�����Br2�����ʵ���Ϊ3mol
D.�����ĺ˴Ź���������12����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�� ����ӵ�ص��ܷ�ӦΪ��LixC+Li1��xCoO2 ![]() C+LiCoO2��
C+LiCoO2��
����ص��ܷ�ӦΪ��2Li+S ![]() Li2S
Li2S
�й��������ֵ��˵����ȷ���ǣ� ��
A.����ӵ�طŵ�ʱ��Li+��Ǩ��
B.����س��ʱ��﮵缫������ԭ��Ӧ
C.���������ֵ�صı�������ͬ
D.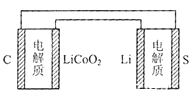 ͼ�б�ʾ������ӵ�ظ�����س��
ͼ�б�ʾ������ӵ�ظ�����س��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڷ��ֵ�һ����Ȼ��ʮ������������Al��Cu��Fe���ֽ���Ԫ����ɣ��ش��������⣺
��1������һ����ƽ�����������ϸ�����λ����Ķ��ؾ��壬��ͨ���������־��塢����ͷǾ��壮
��2����̬Feԭ������δ�ɶԵ��ӣ�Fe3+�ĵ����Ų�ʽΪ �� �������軯�ؼ���Fe3+ �� �γɵ���������ɫΪ ��
��3�����Ʊ���Cu��OH��2�ɽ���ȩ��CH3CHO�����������ᣬ��������ԭ��Cu2O����ȩ��̼ԭ�ӵ��ӻ��������Ϊ��1mol��ȩ�����к��еĦҼ�����ĿΪ �� ����ķе����Ը�����ȩ������Ҫԭ���� �� Cu2OΪ�뵼����ϣ��������������ڲ���4����ԭ�ӣ�������ԭ��λ�����ĺͶ��㣬��þ���������ͭԭ�ӣ�
��4��Al����Ϊ�����������壬�侧������a=0.405nm����������ԭ�ӵ���λ��Ϊ �� ��ʽ��ʾAl���ʵ��ܶ�gcm��3�����ؼ�����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����仯�����ڹ�ҵ����������;�����������Ҫ�ɷ�ΪMg2B2O5H2O��Fe3O4 �� ��������Fe2O3��FeO��CaO��Al2O3��SiO2�ȣ�Ϊԭ���Ʊ����ᣨH3BO3���Ĺ���������ͼ��ʾ�� 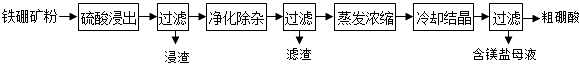
�ش��������⣺
��1��д��Mg2B2O5H2O�����ᷴӦ�Ļ�ѧ����ʽ �� Ϊ��߽������ʣ����ʵ���������Ũ���⣬���ɲ�ȡ�Ĵ�ʩ����д����������
��2�������Ĵ��ԣ��ɽ���ӡ��������з��룮���������л�ʣ�������������ѧʽ����
��3�����������ӡ����ȼ�H2O2��Һ�������� �� Ȼ���ڵ�����Һ��pHԼΪ5��Ŀ����
��4���������ᡱ�е���Ҫ�������������ƣ���
��5��������Ϊԭ�Ͽ��Ƶ����⻯�ƣ�NaBH4���������л��ϳ��е���Ҫ��ԭ���������ʽΪ ��
��6����������������ɾ������������������֣�������ͽ���þΪԭ�Ͽ��Ʊ��������û�ѧ����ʽ��ʾ�Ʊ����� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�˼��ٴ�����Ⱦ����������ƹ�����ʹ�����ȼ�ϣ�Ŀǰʹ�õ����ȼ����Ҫ�����࣬һ����ѹ����Ȼ����CNG������һ����Һ��ʯ������LPG����������ȼ�ϵ���Ҫ�ɷݶ��ǣ� ��
A.̼ˮ������
B.̼�⻯����
C.����
D.����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ�����Ӧʾ��ͼ�Ĺ�ϵ��ȷ���� ( )
A | B | C | D |
�� | �� | ��������Һ����εμ� | �����ʯ��ˮ�л���ͨ�� |
|
|
|
|
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ϵĺϳɣ��������Ļ�ѧ��Ӧ�������������ֲ�ͬ����(����)
A������ϩ���� B��������ϩ����
C����ȩ���� D���۱���ϩ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾˮ�����Թ�����һö���������������۲죺
��1�������������⣬�������ĸ�ʴ������ʴ��
��2�����Թ���Һ����������ԭ��Һ���ԣ�������ʴ���缫��ӦʽΪ�������� �� ��������
��3�����Թ���Һ���½�����ԭ��Һ���ԣ�������ʴ���缫��ӦʽΪ�������� �� ��������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com