
| A、17.6g | B、22.4g |
| C、2.4g | D、4.8g |
| 1 |
| 3 |


科目:高中化学 来源: 题型:
| A、氯碱工业中,电解槽的阳极区产生NaOH |
| B、氯气和氢气混合在光照条件下反应生成氯化氢,用水吸收得到盐酸 |
| C、合成氨工业中,由于氨易液化,N2、H2循环使用,所以总体上氨的产率很高 |
| D、二氧化硫在接触室被氧化成三氧化硫,三氧化硫在吸收塔内被水吸收制成浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 2 |
| 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
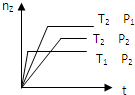 反应2X(?)+Y(g)?2Z(g)△H,在不同温度(T1>T2)及压强(P1>P2)下,产物Z的物质的量(nz)与反应时间(t)的关系如图所示.下列判断正确的是( )
反应2X(?)+Y(g)?2Z(g)△H,在不同温度(T1>T2)及压强(P1>P2)下,产物Z的物质的量(nz)与反应时间(t)的关系如图所示.下列判断正确的是( )| A、△H>0,X为气体 |
| B、△H>0,X为固体 |
| C、△H<0,X为气体 |
| D、△H<0,X为固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 在20℃时,在一刚性容器内部有一个不漏气且可滑动的活塞将容器分隔成左右两室.左室充入氮气,右室充入氢气与氧气的混和气体,活塞恰好停留在离左端的
在20℃时,在一刚性容器内部有一个不漏气且可滑动的活塞将容器分隔成左右两室.左室充入氮气,右室充入氢气与氧气的混和气体,活塞恰好停留在离左端的| 1 |
| 4 |
| A、3:4 | B、1:1 |
| C、2:1 | D、7:2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com