
| A、氯碱工业中,电解槽的阳极区产生NaOH |
| B、氯气和氢气混合在光照条件下反应生成氯化氢,用水吸收得到盐酸 |
| C、合成氨工业中,由于氨易液化,N2、H2循环使用,所以总体上氨的产率很高 |
| D、二氧化硫在接触室被氧化成三氧化硫,三氧化硫在吸收塔内被水吸收制成浓硫酸 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:

| A、该硫酸的物质的量浓度为9.2 mol?L-1 |
| B、该硫酸50 mL与足量的铜反应可得到标准状况下SO2 0.46 mol |
| C、要配制250 mL 4.6 mol?L-1的稀硫酸需取该硫酸62.5 mL |
| D、等质量的水与该硫酸混合所得溶液的物质的量浓度大于9.2 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 分类标准 | 符合该分类标准 |
| A | 电解、水解、裂解、分解 | 潮解 |
| B | CH3COOH、HOOC-COOH、HClO、H2S | HF |
| C | 复分解反应、电解反应、放热反应、离子反应 | 焰色反应 |
| D | (NH4)2SO4、NH4Cl、NH4NO3、NH3?H2O | NH4HCO3 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、①表示随温度升高,平衡常数的变化 |
| B、②表示t1时刻加入催化剂,反应速率随时间的变化 |
| C、③表示恒压条件下,反应物的转化率随充入惰性气体体积的变化 |
| D、④表示CO的体积分数随充入Cl2量的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
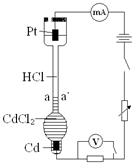 设计如下装置探究HCl溶液中阴、阳离子在电场中的相对迁移速率(已知:Cd的金属活动性大于Cu).恒温下,在垂直的玻璃细管内,先放CdCl2溶液及显色剂,然后小心放入HCl溶液,在aa′处形成清晰的界面.通电后,可观察到清晰界面缓缓向上移动.下列说法正确的是( )
设计如下装置探究HCl溶液中阴、阳离子在电场中的相对迁移速率(已知:Cd的金属活动性大于Cu).恒温下,在垂直的玻璃细管内,先放CdCl2溶液及显色剂,然后小心放入HCl溶液,在aa′处形成清晰的界面.通电后,可观察到清晰界面缓缓向上移动.下列说法正确的是( )| A、通电时,H+、Cd2+向Cd电极迁移,Cl-向Pt电极迁移 | ||||
| B、一定时间内,如果通过HCl溶液某一界面的总电量为1.0 C,测得H+所迁移的电量为0.82 C,说明该HCl溶液中H+的迁移速率约是Cl-的4.6倍 | ||||
| C、如果电源正负极反接,则下端产生大量Cl2,使界面不再清晰,实验失败 | ||||
D、装置中总反应的化学方程式为:2HCl
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol/L的NaHCO3溶液中离子浓度的关系:c(Na+)═c(HCO3-)+c(H2CO3)+2c(CO32-) |
| B、0.1mol/L的NH4Cl溶液和0.1mol/L的NH3?H2O等体积混合后离子浓度的关系:c(NH4+)>c( Cl-)>c(OH-)>c(H+) |
| C、常温下,物质的量浓度相等的醋酸溶液与氢氧化钠溶液等体积混合,所得溶液PH=7 |
| D、KHS溶液中存在等式关系:c(S2-)+c(OH-)=c(H+)+c(H2S) |
查看答案和解析>>
科目:高中化学 来源: 题型:
周期 族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | D | F | H | |||||
| 3 | B | C | E | G | I | J | ||
| 4 | K |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、17.6g | B、22.4g |
| C、2.4g | D、4.8g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com