
| c(H+) |
| c(HF) |
| c(H+).c(F-) |
| c(HF) |
| A、①③④ | B、②③④ |
| C、③④⑤ | D、②⑤ |


科目:高中化学 来源: 题型:
| A、在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH |
| B、用甘氨酸和丙氨酸缩合最多可形成4种二肽 |
| C、分子式为C4H6O2,既能与NaOH溶液反应又能与溴的四氯化碳溶液反应的有机物有4种 |
D、乳酸薄荷醇酯(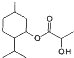 )能发生水解、氧化、消去反应 )能发生水解、氧化、消去反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.16 | B、0.08 |
| C、0.04 | D、0.02 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+、Mg2+.、OH-、Cl- |
| B、Cu2+、Ba2+、NO3-、SO42- |
| C、Na+、Mg2+、CO32-、SO42- |
| D、H+、K+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向铬酸钾饱和溶液中加硫酸,溶液由黄色变为橙色 |
| B、对于可逆反应N2(g)+3H2(g)?2NH3(g)增大氮气浓度可增加活化分子百分数,从而使反应速率增加 |
| C、将AlCl3溶液和NaAlO2溶液分别蒸干后灼烧,所得固体产物均为Al2O3 |
| D、恒容密闭容器中进行的反应3A(g)?B(g)+C(g),在其它条件不变情况下,再充入一定量的A气体,A的转化率将减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向蓝色的CoCl2盐酸溶液中加少量水,溶液变紫色 |
| B、工业合成氨常采用较高压强(20MPa~30 MPa)下进行,以提高原料利用率 |
| C、由H2(g)、I2(g)、HI(g)组成的平衡体系,压缩容器体积后颜色加深 |
| D、工业上生产硫酸的过程中使用适当过量的空气以提高二氧化硫的利用率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
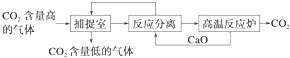
| A、①③ | B、②④ | C、③④ | D、①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2(g)的燃烧热△H=-285.8 kJ?mol-1 |
| B、1molH2O(l)变成1mo1H2O(g),吸收88kJ能量 |
| C、3H2(g)+CO2(g)=CH3OH(l)+H2O(l)△H=+135.9 kJ?mol-1 |
| D、可以寻找特殊催化剂使H2O分解,同时放出能量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com