
【题目】下列离子方程式中正确的是( )
A. 乙醛溶液与新制氢氧化铜碱性悬浊液共热: CH3CHO + 2Cu(OH)2 + OH- ![]() CH3COO- + Cu2O↓+ 3H2O
CH3COO- + Cu2O↓+ 3H2O
B. 碳酸钠溶液与醋酸反应:CO32- + 2H+ = CO2↑+ H2O
C. 用Fe除去FeCl2溶液中的少量的FeCl3杂质:Fe+Fe3+=2Fe2+
D. 将1~2mL氯化铁饱和溶液加到20mL沸水中:Fe3+ + 3H2O = Fe(OH)3(胶体) + 3H+
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:
【题目】如图所示是一个制取Cl2并以Cl2为原料进行特定反应的装置,多余的Cl2可以贮存在b瓶中,其中各试剂瓶中所装试剂为:B(氢硫酸)、C(淀粉KI溶液)、D(水)、F(紫色石蕊试液)。

(1)若装置A烧瓶中的固体为MnO2,液体为浓盐酸,则其发生反应的化学方程式为____________________________________________________。
(2)装置E中硬质玻璃管内盛有炭粉,若E中发生氧化还原反应,其产物为二氧化碳和氯化氢,写出E中反应的化学方程式:_________________________________________。
(3)D中溶液的存在含氯的阴离子为___________________________。
(4)在F中紫色石蕊试液的颜色由紫色变为红色,再变为无色,其原因是__________________________。
(5)若F中盛有NaOH溶液,其作用是_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究等质量的铁与过量的盐酸在不同的实验条件下进行反应,测得在不同时间(t)内产生气体体积(V)的数据如图所示,根据图示分析实验条件,下列说法中不正确的是
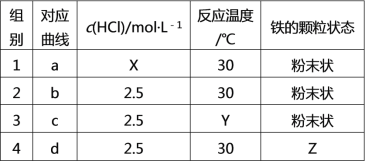
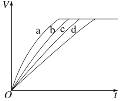
A. 第1、2组实验的目的是探究浓度对反应速率影响X > 2.5
B. 第2、3组实验的目的是探究温度对反应速率影响Y < 30
C. 第2、4组实验的目的是探究铁的颗粒状态对反应速率影响Z为片状
D. 第3组实验一定加了催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家研发了一种室温下“可呼吸”的Na-CO2二次电池。将NaClO4溶于有机溶剂作电解液,钠和负载碳纳米管的镍网分别作电极材料,电池的总反应为3CO2+4Na![]() 2Na2CO3+C。下列说法错误的是( )
2Na2CO3+C。下列说法错误的是( )

A.放电时,ClO4-向负极移动
B.充电时释放CO2,放电时吸收CO2
C.放电时,正极反应式为3CO2+4e-=2CO32-+C
D.放电时,负极反应式为Na++e-=Na
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的前四周期,请回答有关问题:(相关均用具体化学用语回答)
1 | ① | |||||||
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
4 | ⑨ | ⑩ | ||||||
(1)元素⑤⑥⑦的简单离子半径大小顺序__________;②在元素周期表位置________;③的简单氢化物和⑧的氢化物混合形成的化合物电子式__________。
(2)⑤其最高价氧化物水合物和⑥的最高价氧化物反应的离子方程式_______
(3)用电子式表示元素①和⑧形成的化合物的形成过程__________。
(4)④、⑧、⑩的氢化物沸点最高的是__________,原因是__________。
(5)由②和①组成最简单物质与O2和⑨的最高价氧化物对应的水化物的水溶液组成燃料电池,写出电池的负极反应式__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是常见四种有机物的比例模型示意图。下列说法不正确的是( )
A.  能使酸性高锰酸钾溶液褪色
能使酸性高锰酸钾溶液褪色
B.  可与溴水发生加成反应使溴水褪色
可与溴水发生加成反应使溴水褪色
C.  中的碳碳键是介于碳碳单键和碳碳双键之间的独特的键
中的碳碳键是介于碳碳单键和碳碳双键之间的独特的键
D.  在浓硫酸作用下可与乙酸发生取代反应
在浓硫酸作用下可与乙酸发生取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于以下研究和方法不正确的是( )
A.生物质能源是可再生的能源,可以作为解决农村能源的主要途径
B.对于反应2SO2(g)+O2(g)![]() 2SO3(g)寻找合适的催化剂可以大大加快反应速率,提高生产效率
2SO3(g)寻找合适的催化剂可以大大加快反应速率,提高生产效率
C.寻找高效催化剂,使水分解产生氢气,同时释放能量
D.实验室欲快速制取H2,可将浸泡过CuSO4溶液的Zn跟稀硫酸反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用铅蓄电池电解甲、乙电解池中的溶液。已知铅蓄电池的总反应为Pb(s)+PbO2(s)+2H2SO4(aq)![]() 2PbSO4(s)+2H2O(l)。电解一段时间后向,c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是( )
2PbSO4(s)+2H2O(l)。电解一段时间后向,c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是( )

A. 若利用甲池精炼铜,b极应为粗铜
B. d极为阴极
C. 放电时铅蓄电池负极的电极反应式:PbO2(s)+4H+(aq)+SO42-(aq)+2e-=PbSO4(s)+2H2O(l)
D. 若四个电极材料均为石墨,当析出6.4 g Cu时,两池中共产生气体3.36 L(标准状况下)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钢铁工业是国家工业的基础,钢铁生锈现象却随处可见,为此每年国家损失大量资金。请回答钢铁腐蚀与防护过程中的有关问题。
(1)钢铁的电化学腐蚀原理如图所示:

①写出石墨电极的电极反应式______;
②将该装置作简单修改即可成为钢铁电化学防护的装置,请在如图虚线框内所示位置作出修改,并用箭头标出导线中电子流动方向。______
③写出修改后石墨电极的电极反应式______。
(2)生产中可用盐酸来除铁锈。现将一生锈的铁片放入盐酸中,当铁锈被除尽后,溶液中发生的化合反应的化学方程式_____。
(3)在实际生产中,可在铁件的表面镀铜防止铁被腐蚀。装置示意图如图:

①A电极对应的金属是__(写元素名称),B电极的电极反应式是____。
②若电镀前铁、铜两片金属质量相同,电镀完成后将它们取出洗净、烘干、称量,二者质量差为5.12g,则电镀时电路中通过的电子为___ mol。
③镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,请简要说明原因___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com