
【题目】如图是常见四种有机物的比例模型示意图。下列说法不正确的是( )
A.  能使酸性高锰酸钾溶液褪色
能使酸性高锰酸钾溶液褪色
B.  可与溴水发生加成反应使溴水褪色
可与溴水发生加成反应使溴水褪色
C.  中的碳碳键是介于碳碳单键和碳碳双键之间的独特的键
中的碳碳键是介于碳碳单键和碳碳双键之间的独特的键
D.  在浓硫酸作用下可与乙酸发生取代反应
在浓硫酸作用下可与乙酸发生取代反应
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组用如图所示装置探究苯与溴的反应原理。

请回答下列问题:
(1) 仪器M的名称为__________。
(2) 装置Ⅰ中铁丝除做催化剂外,还可控制反应的进行,使反应停止的操作是__________。
(3)装置Ⅰ中生成溴苯的化学方程式为______________________________。
(4)冷凝管的进水口为________((填“a”或“b”),下同;其作用是_____________;
(5)能验证苯与液溴发生的是取代反应的现象是______________;
(6)装置Ⅱ中,若撤去装有苯的小试管,将导管直接插入硝酸银溶液,对实验目的达成会产生什么影响__________________________
(7)装置III中的离子反应方程式为_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在20mL bmol·L﹣1KOH溶液中逐滴加入0.1mol·L﹣1醋酸溶液,溶液pH和加入醋酸的体积关系曲线如图所示,下列关系不正确的是
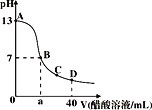
A. a=20
B. b=0.1
C. 在C点:c(CH3COO﹣)>c(K+)>c(H+)>c(OH﹣)
D. 在D点:c(CH3COO﹣)+c(CH3COOH)=2c(K+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某离子晶体晶胞的结构如图所示。X(●)位于立方体顶点,Y(○)位于立方体中心。试

(1)晶体中每个Y同时吸引着__个X,每个X同时吸引着__个Y,该晶体的化学式为____________。
(2)晶体中每个X周围与它最接近且距离相等的X共有___个。
(3)晶体中距离最近的2个X与1个Y形成的夹角∠XYX是____。
(4)设该晶体的摩尔质量为Mg·mol-1,晶体密度为ρg·cm-3,阿伏加德罗常数的值为NA,则晶体中两个距离最近的X中心间距为___cm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中正确的是( )
A. 乙醛溶液与新制氢氧化铜碱性悬浊液共热: CH3CHO + 2Cu(OH)2 + OH- ![]() CH3COO- + Cu2O↓+ 3H2O
CH3COO- + Cu2O↓+ 3H2O
B. 碳酸钠溶液与醋酸反应:CO32- + 2H+ = CO2↑+ H2O
C. 用Fe除去FeCl2溶液中的少量的FeCl3杂质:Fe+Fe3+=2Fe2+
D. 将1~2mL氯化铁饱和溶液加到20mL沸水中:Fe3+ + 3H2O = Fe(OH)3(胶体) + 3H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:![]() ,为合成某种液晶材料的中间体M,有人提出如下不同的合成途径:
,为合成某种液晶材料的中间体M,有人提出如下不同的合成途径:

(1)常温下,下列物质能与A发生反应的有_______ (填序号)
a.乙酸 b.Br2/CCl4 c.乙酸乙酯 d.KMnO4/H+溶液
(2)M中官能团的名称是___________,由C→B反应类型为________ 。
(3)由A催化加氢生成M的过程中,可能生成的中间产物除了![]() 还有________(写结构简式)。
还有________(写结构简式)。
(4)检验B中是否含有C可选用的试剂是_____________。
(5)C的一种同分异构体E具有如下特点:a.分子中含—OCH2CH3 b.苯环上只有两种化学环境不同的氢原子,写出E在一定条件下发生加聚反应的化学方程式_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,下列叙述不能作为可逆反应A(g)+3B(g)![]() 2C(g)达到平衡状态标志的是( )
2C(g)达到平衡状态标志的是( )
①C的生成速率与C的消耗速率相等 ②单位时间内生成amol A,同时生成3amol B ③A、B、C的浓度不再变化 ④C的物质的量不再变化 ⑤混合气体的总压强不再变化 ⑥混合气体的总物质的量不再变化 ⑦单位时间消耗amol A,同时生成3amol B ⑧A、B、C的分子数之比为1∶3∶2
A. ②⑧ B. ④⑦ C. ①③ D. ⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全国平板玻璃生产企业大气污染物年排放总量逐年增加,对氮氧化物(NOx)排放的控制与监测已刻不容缓。回答下列问题
(1)平板玻璃熔窑烟气中的NOx以温度型氮氧化物为主。其中NO在空气中容易被一种三原子气体单质氧化剂和光化学作用氧化成NO2,该氧化剂的分子式为___________。
(2)用CH4催化还原NOx可在一定程度上消除氮氧化物的污染。
已知:CH4(g)+4NO2(g)![]() 4NO(g)+CO2(g)+2H2O(g) △H=-574kJ·mol-1
4NO(g)+CO2(g)+2H2O(g) △H=-574kJ·mol-1
2NO2(g)+N2(g)![]() 4NO(g) △H=+293kJ·mol-1
4NO(g) △H=+293kJ·mol-1
则反应CH4(g)+4NO(g)![]() 2N2(g)+CO2(g)+2H2O(g)的△H=___________kJ·mol-1
2N2(g)+CO2(g)+2H2O(g)的△H=___________kJ·mol-1
(3)800℃时,在刚性反应器中以投料比为1︰1的NO(g)与O2(g)反应:

其中NO2二聚为N2O4的反应可以迅速达到平衡。体系的总压强p随时间t的变化如下表所示[t=∞时,NO(g)完全反应]。

①NO(g)与O2(g)合成的反应速率v=4.2×10-2×p2(NO)×p(O2)(kPa·min-1),t=52min时,测得体系中p(O2)=11.4kPa,则此时的p(NO)=___________kPa, v=___________kPa·min-1(计算结果保留1位小数)。
②若升高反应温度至900℃,则NO(g)与O2(g)完全反应后体系压强p∞(900℃)______(填“大于”等于”或“小于”)22.3kPa,原因是______________________。
③800℃时,反应N2O4(g)![]() 2NO2(g)的平衡常数Kp=___________kPa(Kp为以分压表示的平衡常数,计算结果保留2位小数)。
2NO2(g)的平衡常数Kp=___________kPa(Kp为以分压表示的平衡常数,计算结果保留2位小数)。
(4)对于反应2NO(g)+O2(g)→2NO2(g),科研工作者提出如下反应历程:
第一步:2NO(g)![]() N2O2(g) 快速平衡
N2O2(g) 快速平衡
第二步:N2O2+O2(g)→2NO2(g) 慢反应
下列表述正确的是___________(填标号)。
A.v(第一步的逆反应)>v第二步反应
B.反应的中间产物为N2O2
C.第二步中N2O2与O2的碰撞全部有效
D.第二步反应活化能较低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或表示方法正确的是
A. 由C(石墨,s)=C(金刚石,s)ΔH = +1.9 kJ·mol-1可知,金刚石比石墨稳定
B. 已知S(g)+O2(g)═SO2(g) ΔΗ1 ;S(s)+O2(g)═SO2(g) ΔΗ2 ,则ΔΗ1<ΔΗ2
C. 在101kPa时,2g H2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)![]() 2H2O(l) ΔH = +285.8 kJ·mol-1
2H2O(l) ΔH = +285.8 kJ·mol-1
D. 在稀溶液中:H +(aq)+OH -(aq)= H2O(l)ΔH =-57.3 kJ·mol-1,若将含1mol CH3COOH与含1mol NaOH的溶液混合,放出的热量等于57.3 kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com