
ЁОЬтФПЁПЬНОПЕШжЪСПЕФЬњгыЙ§СПЕФбЮЫсдкВЛЭЌЕФЪЕбщЬѕМўЯТНјааЗДгІЃЌВтЕУдкВЛЭЌЪБМф(t)ФкВњЩњЦјЬхЬхЛ§(V)ЕФЪ§ОнШчЭМЫљЪОЃЌИљОнЭМЪОЗжЮіЪЕбщЬѕМўЃЌЯТСаЫЕЗЈжаВЛе§ШЗЕФЪЧ
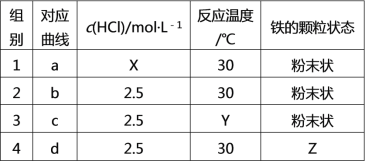
A. Ек1ЁЂ2зщЪЕбщЕФФПЕФЪЧЬНОПХЈЖШЖдЗДгІЫйТЪгАЯьX > 2.5
B. Ек2ЁЂ3зщЪЕбщЕФФПЕФЪЧЬНОПЮТЖШЖдЗДгІЫйТЪгАЯьY < 30
C. Ек2ЁЂ4зщЪЕбщЕФФПЕФЪЧЬНОПЬњЕФПХСЃзДЬЌЖдЗДгІЫйТЪгАЯьZЮЊЦЌзД
D. Ек3зщЪЕбщвЛЖЈМгСЫДпЛЏМС
ЁОД№АИЁПD
ЁОНтЮіЁП
ЯрЭЌЪБМфФкЩњГЩЧтЦјЕФЬхЛ§дНДѓЃЌЫЕУїЗДгІЫйТЪдНПьЃЌгЩЭМПЩжЊЃЌЗДгІЫйТЪaЃОbЃОcЃОdЃЛ
ИљОнЭтНчЬѕМўЃЈХЈЖШЁЂЮТЖШЁЂбЙЧПЁЂДпЛЏМСЁЂЙЬЬхБэУцЛ§ЃЉЖдЛЏбЇЗДгІЫйТЪЕФгАЯьНјааЗжЮіЃЛ
ЮТЖШдНИпЁЂЙЬЬхБэУцЛ§дНДѓЁЂЗДгІЮяЕФХЈЖШдНДѓЃЌЛЏбЇЗДгІЫйТЪдНПьЃЌОнДЫНтД№ЁЃ
ЯрЭЌЪБМфФкЩњГЩЧтЦјЕФЬхЛ§дНДѓЃЌЫЕУїЗДгІЫйТЪдНПьЃЌгЩЭМПЩжЊЃЌЗДгІЫйТЪaЃОbЃОcЃОdЃЛ
AЁЂЕк1ЁЂ2зщЪЕбщБШНЯЃЌЕк1зщЪЕбщЗДгІЫљгУЪБМфЖЬЃЌЙЪЗДгІЫйТЪПьЃЌИљОнПижЦБфСПЗЈЕФддђжЊЕк1зщЪЕбщбЮЫсЕФХЈЖШгІДѓгк2.5molL-1ЃЌМДX > 2.5ЃЌЙЪAе§ШЗЃЛ
BЁЂЕк2ЁЂ3зщЪЕбщЃЌЕк2зщЗДгІЫйТЪБШЕк3зщПьЃЌ2ЁЂ3зщЯрБШЃЌХЈЖШЁЂЙЬЬхБэУцЛ§ЯрЭЌЃЌЮТЖШдНИпЗДгІЫйТЪдНПьЃЌЙЪЕк3зщЪЕбщЕФЗДгІЮТЖШЕЭгк30ЁцЃЌМДY < 30ЃЌЙЪBе§ШЗЃЛ
CЁЂЕк2ЁЂ4зщЪЕбщЃЌЕк2зщЪЕбщЃЌЬњЪЧЗлФЉзДЃЌИљОнПижЦБфСПЗЈддђжЊЕк4зщЪЕбщЬњЮЊЦЌзДЃЌМДZЮЊЦЌзДЃЌЙЪCе§ШЗЃЛ
DЁЂДпЛЏМСФмМгПьЗДгІЫйТЪЃЌЖјгЩЭМжЊЃЌЗДгІЫйТЪaЃОbЃОcЃОdЃЌЫљвдЕк3зщЪЕбщВЛвЛЖЈЪЧМгСЫДпЛЏМСЃЌЙЪDДэЮѓЁЃ
ЙЪбЁDЁЃ



| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁП(l)![]() ЃНH2O(g) ЁїH1ЃНa kJЁЄ
ЃНH2O(g) ЁїH1ЃНa kJЁЄ![]()
(2)![]() ЃН2H2O(g) ЁїH2ЃНb kJЁЄ
ЃН2H2O(g) ЁїH2ЃНb kJЁЄ![]()
(3)![]() ЃНH2O(l) ЁїH3ЃНc kJЁЄ
ЃНH2O(l) ЁїH3ЃНc kJЁЄ![]()
(4)![]() ЃН2H2O(l) ЁїH4ЃНd kJЁЄ
ЃН2H2O(l) ЁїH4ЃНd kJЁЄ![]()
ЯТСаЙиЯЕЪНжае§ШЗЕФЪЧ( )
A. aЃМcЃМ0 B. bЃОdЃО0 C. 2aЃНbЃМ0 D. 2cЃНdЃО0
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПtЁцЪБЃЌНЋ2molЦјЬхAКЭ1molЦјЬхBГфШыШнЛ§ЮЊ2LЕФКуШнУмБеШнЦїжаЃЌЗЂЩњШчЯТЗДгІЃК2A(g)+B(g)![]() xC(g)ЃЌ2minЪБЛЏбЇЗДгІДяЕНЯоЖШ(ЮТЖШШдЮЊtЁц)ЃЌДЫЪБBЛЙга 0.6molЃЌВЂВтЕУCЕФХЈЖШЮЊ0.6mol/LЁЃЧыЛиД№ЯТСаЮЪЬтЃК
xC(g)ЃЌ2minЪБЛЏбЇЗДгІДяЕНЯоЖШ(ЮТЖШШдЮЊtЁц)ЃЌДЫЪБBЛЙга 0.6molЃЌВЂВтЕУCЕФХЈЖШЮЊ0.6mol/LЁЃЧыЛиД№ЯТСаЮЪЬтЃК
(1)ХаЖЯИУЗДгІДяЕНЯоЖШЕФБъжОЪЧ_____________ ЁЃ
aЃЎШнЦїжаЕФбЙЧПБЃГжВЛБф
bЃЎAЕФЩњГЩЫйТЪгыBЕФЯћКФЫйТЪжЎБШЮЊ2ЃК1
cЃЎШнЦїФкЛьКЯЦјЬхЕФУмЖШБЃГжВЛБф
dЃЎAЕФАйЗжКЌСПБЃГжВЛБф
eЃЎBКЭCЕФЮяжЪЕФСПХЈЖШжЎБШЮЊ1ЃКx
(2)x=_______ЃЌ ДгЗДгІПЊЪМЕНДяЕНЯоЖШЪБЃЌгУBБэЪОИУЗДгІЕФЦНОљЗДгІЫйТЪV(B)=_________ЃЛ
(3)ШєБЃГжЮТЖШВЛБфЃЌдіДѓШнЦїЬхЛ§ЃЌдђе§ЗДгІЫйТЪ___(ЬюЁАдіДѓЁБЁЂЁАМѕаЁЁБЛђЁАВЛБфЁБ)
(4)ЛЏбЇЗДгІДяЕНЯоЖШЪБЃЌAЕФзЊЛЏТЪЮЊ__________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПГЃЮТЪБЃЌдкH2CO3ШмвКжаж№ЕЮМгШыNaOHШмвКЃЌШмвКжаH2CO3ЁЂHCO3-КЭCO32-ЕФЮяжжЗжВМЗжЪ§![]() (X)=
(X)=![]() гыpHЕФЙиЯЕШчЭМЫљЪОЃК
гыpHЕФЙиЯЕШчЭМЫљЪОЃК

ЯТСаЫЕЗЈе§ШЗЕФЪЧ
A. ЗДгІHCO3-![]() HЃЋЃЋCO32-ЕФlgK=-6.4
HЃЋЃЋCO32-ЕФlgK=-6.4
B. pHЈT8ЕФШмвКжаЃКcЃЈNaЃЋЃЉ>cЃЈHCO3-ЃЉ
C. NaHCO3ШмвКжаЕЮШыЩйСПбЮЫсжСШмвКЯджаадЃКcЃЈNaЃЋЃЉЈTcЃЈCl-ЃЉ
D. ЯђpH=6.4ЕФШмвКжаЕЮМгNaOHШмвКжСpH=8ЃЌжївЊЗЂЩњЕФРызгЗДгІЃКHCO3-ЃЋOH-ЈTCO32-ЃЋH2O
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПШчЭМЪЧПЮЭтЛюЖЏаЁзщЩшМЦЕФгУЛЏбЇЕчдДЪЙLEDЕЦЗЂЙтЕФзАжУЁЃЯТСаЫЕЗЈе§ШЗЕФЪЧ

A. аПЪЧИКМЋЃЌЕчзгДгЭЦЌОЕМЯпСїЯђаПЦЌ
B. ЭЦЌЩЯЕФЕчМЋЗДгІЪНЮЊ2H+ + 2e- =H2Ёќ
C. ШчЙћНЋЭЦЌЛЛГЩЬњЦЌЃЌЕчТЗжаЕФЕчСїЗНЯђНЋИФБф
D. зАжУжажЛДцдкЁАЛЏбЇФмЁњЕчФмЁБЕФзЊЛЛ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПдк20mL bmolЁЄLЉ1KOHШмвКжаж№ЕЮМгШы0.1molЁЄLЉ1ДзЫсШмвКЃЌШмвКpHКЭМгШыДзЫсЕФЬхЛ§ЙиЯЕЧњЯпШчЭМЫљЪОЃЌЯТСаЙиЯЕВЛе§ШЗЕФЪЧ
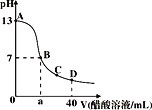
A. a=20
B. b=0.1
C. дкCЕуЃКc(CH3COOЉ)ЃОc(K+)ЃОc(H+)ЃОc(OHЉ)
D. дкDЕуЃКc(CH3COOЉ)+c(CH3COOH)=2c(K+)
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПИљОндЊЫижмЦкБэКЭдЊЫижмЦкТЩЃЌХаЖЯЯТСаа№ЪіВЛе§ШЗЕФЪЧ

A. ЦјЬЌЧтЛЏЮяЕФЮШЖЈадЃКH2OЃОNH3ЃОSiH4
B. ЧтдЊЫигыЦфЫћдЊЫиПЩаЮГЩЙВМлЛЏКЯЮяЛђРызгЛЏКЯЮя
C. ЩЯЭМЫљЪОЪЕбщПЩжЄУїдЊЫиЕФЗЧН№ЪєадЃКClЃОCЃОSi
D. гУжаЮФЁА![]() ЁБЃЈЈЄoЃЉУќУћЕФЕк118КХдЊЫидкжмЦкБэжаЮЛгкЕкЦпжмЦк0зх
ЁБЃЈЈЄoЃЉУќУћЕФЕк118КХдЊЫидкжмЦкБэжаЮЛгкЕкЦпжмЦк0зх
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаРызгЗНГЬЪНжае§ШЗЕФЪЧ(ЁЁЁЁ)
A. ввШЉШмвКгыаТжЦЧтбѕЛЏЭМюадаќзЧвКЙВШШЃК CH3CHO + 2Cu(OH)2 + OH- ![]() CH3COO- + Cu2OЁ§+ 3H2O
CH3COO- + Cu2OЁ§+ 3H2O
B. ЬМЫсФЦШмвКгыДзЫсЗДгІЃКCO32- + 2H+ = CO2Ёќ+ H2O
C. гУFeГ§ШЅFeCl2ШмвКжаЕФЩйСПЕФFeCl3дгжЪЃКFeЃЋFe3+ЃН2Fe2+
D. НЋ1~2mLТШЛЏЬњБЅКЭШмвКМгЕН20mLЗаЫЎжаЃКFe3+ + 3H2O = Fe(OH)3(НКЬх) + 3H+
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПШчЭМЫљЪОЪЧвЛЬзЕчЛЏбЇЪЕбщзАжУ,ЭМжаCЁЂDОљЮЊВЌЕчМЋЃЌUЮЊбЮЧХЃЌGЪЧСщУєЕчСїМЦЃЌЦфжИеызмЪЧЦЋЯђЕчдДе§МЋЁЃ

(1)As(Щщ)ЮЛгкдЊЫижмЦкБэжаЕк4жмЦкЕкЂѕAзхЃЌдђNa3AsO4ШмвКЕФpH_________(ЬюЁА>ЁБЁА<ЁБЛђЁА=ЁБ)7ЁЃ
(2)ЯђBБжаМгШыЪЪСПНЯХЈЕФСђЫсЃЌЗЂЯжGЕФжИеыЯђгвЦЋвЦЁЃДЫЪБAБжаЕФжївЊЪЕбщЯжЯѓЪЧ_____ЃЌDЕчМЋЩЯЕФЕчМЋЗДгІЪНЮЊ___________ЁЃ
(3)вЛЖЮЪБМфКѓЃЌдйЯђBБжаМгШыЪЪСПЕФжЪСПЗжЪ§ЮЊ40%ЕФЧтбѕЛЏФЦШмвКЃЌЗЂЯжGЕФжИеыЯђзѓЦЋвЦЁЃДЫЪБећЬзЪЕбщзАжУЕФзмЕФРызгЗНГЬЪНЮЊ________________ЁЃ
(4)дйЙ§вЛЖЮЪБМфКѓЃЌGЕФжИеыж№НЅЙщСуЃЌДЫЪБЪЕбщзАжУжаЕФЛЏбЇЗДгІвбОДяЕНЛЏбЇЦНКтзДЬЌЃЌИУЗДгІЕФЛЏбЇЦНКтГЃЪ§ЕФБэДяЪНЮЊЃКK=________________ЁЃ
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com