
【题目】如图是课外活动小组设计的用化学电源使LED灯发光的装置。下列说法正确的是

A. 锌是负极,电子从铜片经导线流向锌片
B. 铜片上的电极反应式为2H+ + 2e- =H2↑
C. 如果将铜片换成铁片,电路中的电流方向将改变
D. 装置中只存在“化学能→电能”的转换
 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源: 题型:
【题目】已知某物质X能发生如下转化,下列有关上述转化关系中物质及其反应的叙述不正确的是

A. 若X为N2或NH3,则A为硝酸
B. 若X为S或H2S,则A为硫酸
C. 若X为非金属单质或非金属氢化物,则A不一定能与金属铜反应生成Y
D. 反应①和②一定为氧化还原反应,反应③一定为非氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A.密闭容器中,1molN2和3molH2催化反应后分子总数为2NA
B.100g98%的浓H2 SO4与过量的Cu反应后,电子转移数为NA
C.标准状况下,11.2L氧气和二氧化碳混合物中含氧原子数目为NA
D.1L1mol/LNa2CO3溶液中所含阴离子数目小于NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素。一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化):
实验序号 | A溶液 | B溶液 |
① | 20 mL 0.1 mol·L-1H2C2O4溶液 | 30 mL 0.01 mol·L-1KMnO4溶液 |
② | 20 mL 0.2 mol·L-1H2C2O4溶液 | 30 mL 0.01 mol·L-1KMnO4溶液 |

(1)该反应的离子方程式 。(已知H2C2O4是二元弱酸)
(2)该实验探究的是 因素对化学反应速率的影响。相同时间内针筒中所得CO2的体积大小关系是 < (填实验序号)。
(3)若实验①在2 min末收集了2.24 mL CO2(标准状况下),则在2 min末, c(MnO4-)=__________mol/L(假设混合液体积为50 mL)
(4)除通过测定一定时间内CO2的体积来比较反应速率,本实验还可通过测定 来比较化学反应速率。(一条即可)
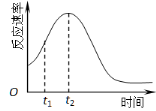 (5)小组同学发现反应速率总是如图,其中t1~t2时间内速率变快的主要原因可能是:
(5)小组同学发现反应速率总是如图,其中t1~t2时间内速率变快的主要原因可能是:

① ;② 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国是世界上最早制得和使用金属锌的国家。一种以闪锌矿(主要成份是ZnS,含有SiO2和少量FeS、CdS、PbS杂质)为原料制备金属锌的流程如图所示:

相关金属离子[c(Mn+)=0.10mol·L–1]形成氢氧化物沉淀的pH范围如下:
金属离子 | Fe3+ | Fe2+ | Zn2+ | Cd2+ |
开始沉淀的pH | 1.5 | 6.3 | 6.3 | 7.4 |
沉淀完全的pH | 2.8 | 8.3 | 8.2 | 9.4 |
回答下列问题:
(1)写出ZnS的电子式__________________________;
焙烧过程中主要反应的化学方程式为__________________________。
(2)滤渣1的成分为:___________________;
(3)试剂Y是_________(只要求填写一种), 调PH值的范围是___________________。
(4)电解硫酸锌溶液制备单质锌时,电解的总反应离子方程式为:___________________。
(5)为将溶液中的Fe2+氧化,试剂X可选用的是_______。(填序号)
A.H2O2 B.H2S C.HNO3 D.O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究等质量的铁与过量的盐酸在不同的实验条件下进行反应,测得在不同时间(t)内产生气体体积(V)的数据如图所示,根据图示分析实验条件,下列说法中不正确的是
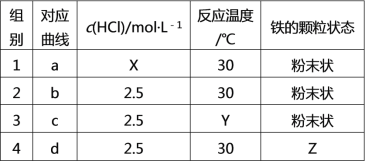
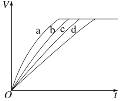
A. 第1、2组实验的目的是探究浓度对反应速率影响X > 2.5
B. 第2、3组实验的目的是探究温度对反应速率影响Y < 30
C. 第2、4组实验的目的是探究铁的颗粒状态对反应速率影响Z为片状
D. 第3组实验一定加了催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4-CO2催化重整不仅可以得到合成气(CO和H2),还对温室气体的减排具有重要意义。
已知:CH4(g)+O2(g)=CO2(g)+2H2(g)ΔH=-319kJ·mol1
CO(g)+1/2O2(g)=CO2(g)ΔH=-283kJ·mol1
回答下列问题:
(1)写出CH4-CO2催化重整反应的热化学方程式:_______________________________。
(2)某温度下,向密闭容器中充入CH4与CO2,发生CH4-CO2催化重整反应。测得平衡混合物中CO(g)的体积分数[φ(CO)]与起始投料比Z[Z=n(CH4)/n(CO2)]的关系如图所示;

①当Z=2时,CO2的平衡转化率ɑ=__________%。
②当Z=3时,反应达到平衡状态后,CO的体积分数可能是图1中的_________点(填“C”、“D”或“E”)。
(3)若CO2的平衡转化率(a)与温度(T)、压强(p)的关系如图所示。

①由图可知压强p1__________p2(选填“>”、“<“或“=”);
②在温度为T5℃,压强为P1条件下,向2L密闭容器中充入1molCH4与1molCO2发生CH4-CO2催化重整反应,则此条件下该反应的平衡常数为:_____________________;达平衡后若再充入1.5molCH4、1.5molCO2、1molCO、1molH2,则此时v正_______v逆(选填“>”、“<“或“=”);在该条件下,以下能说明该反应已达平衡的是________________。
A.CH4与CO2的物质的量比为1:1
B.氢气的体积分数不变
C.混合气体的平均摩尔质量保持不变
D.当消耗1mol的CO2同时,有2mol的CO生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的前四周期,请回答有关问题:(相关均用具体化学用语回答)
1 | ① | |||||||
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
4 | ⑨ | ⑩ | ||||||
(1)元素⑤⑥⑦的简单离子半径大小顺序__________;②在元素周期表位置________;③的简单氢化物和⑧的氢化物混合形成的化合物电子式__________。
(2)⑤其最高价氧化物水合物和⑥的最高价氧化物反应的离子方程式_______
(3)用电子式表示元素①和⑧形成的化合物的形成过程__________。
(4)④、⑧、⑩的氢化物沸点最高的是__________,原因是__________。
(5)由②和①组成最简单物质与O2和⑨的最高价氧化物对应的水化物的水溶液组成燃料电池,写出电池的负极反应式__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中错误的是( )
A. 把aL0.1mol/L的CH3COOH溶液与bL0.1mol/L的KOH溶液混合,所得溶液中一定存在:c(K+)+c(H+)=c(CH3COO-)+c(OH-)
B. 把0.1mol/L的NaHCO3溶液与0.3mol/L的Ba(OH)2溶液等体积混合,所得溶液中一定存在:c(OH-)>c(Ba2+)>c(Na+)>c(H+)
C. 向1mol/L的CH3COOH溶液中加入少量CH3COONa固体,由于CH3COONa水解显碱性,所以溶液的pH升高
D. 常温下,在pH=3的CH3COOH溶液和pH=11的NaOH溶液中,水的电离程度相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com