
| A. | 进行蒸馏操作时冷凝管进水的方向是上进下出 | |
| B. | 用酒精萃取碘水中的碘 | |
| C. | 用蒸发方法使NaCl 从溶液中析出时,应将蒸发皿中NaCl 溶液全部加热蒸干 | |
| D. | 用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中 |
分析 A.进行蒸馏操作时应使冷水充满冷水;
B.酒精与水混溶;
C.蒸发时应防止固体迸溅;
D.浓硫酸溶于水放出大量的热,且容量瓶只能在常温下使用.
解答 解:A.进行蒸馏操作时应使冷凝管充满冷水,水从下端进,故A错误;
B.萃取剂不能溶于水,酒精与水混溶,不能用作萃取剂,故B错误;
C.蒸发时当有大量固体剩余时停止加热,以防止固体迸溅,故C错误;
D.浓硫酸溶于水放出大量的热,且容量瓶只能在常温下使用,则浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中,故D正确.
故选D.
点评 本题考查化学实验方案的评价,为高频考点,侧重于学生的分析能力和实验能力的考查,注意把握实验的严密性和可行性的评价,难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.045 mol/L | B. | 1 mol/L | C. | 0.5 mol/L | D. | 2.24mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
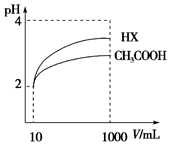 25℃时,电离平衡常数:
25℃时,电离平衡常数:| 化学式 | CH3COOH | H2CO3 | HClO | |
| 电离平衡常数 | 1.8×10-5 | K1 4.3×10-7 K2 5.6×10-11 | 3.0×10-8 | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选 项 | 操 作 | 现 象 | 结 论 |
| A | 向无水乙醇中滴入酸性KMnO4溶液,充分振荡 | 紫红色褪去 | 乙醇有氧化性 |
| B | 向某溶液中滴加BaCl2溶液 | 生成白色沉淀 | 原溶液中一定有SO42- |
| C | 向某无色溶液中滴加氯水和CCl4,振荡、静置 | 下层溶液显紫色 | 原溶液中有I- |
| D | 向某溶液中滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中无NH4+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓氨水可检验氯气管道漏气 | |
| B. | 碘是人体必需微量元素,所以要多吃富含高碘酸的食物 | |
| C. | 二氧化硫通入次氯酸钠溶液:SO2+ClO-+H2O=SO42-+Cl-+2H+ | |
| D. | 冷的NaOH溶液中通入Cl2:Cl2+2OH-═Cl-+ClO-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 操作 | 现象 | 结论 | |
| A | 滴加稀盐酸 | 有气泡产生 | 原溶液中有CO32- |
| B | 滴加盐酸酸化的BaCl2溶液 | 生成白色沉淀 | 原溶液中有Ag+或SO42- |
| C | 用洁净铂丝蘸取溶液进行灼烧 | 火焰呈黄色 | 原溶液中有Na+、无K+ |
| D | 滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管 | 试纸不变蓝 | 原溶液中无NH4+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 摩尔是用来描述物质所含微粒数目多少的基本物理量 | |
| B. | 1 mol氯约含有 6.02×1023个微粒 | |
| C. | 水的摩尔质量是它的相对分子质量 | |
| D. | 1 cm3铁所含有的铁原子数是$\frac{ρ•{N}_{A}}{56}$( ρ是铁的密度,单位为 g/cm3) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com