
【题目】下面是元素周期表的一部分,请按要求填空:
A | C | ||||||||||||||||
B | D | E | |||||||||||||||
F | |||||||||||||||||
(1)A元素最高价氧化物的化学式为_______。
(2)单质A与C在放电时形成的化合物为________(填化学式)。
(3)F、E元素最高价氧化物对应的水化物酸性比较:_____(填化学式)。
(4)B在C中燃烧形成的化合物电子式:____________________。
(5)化合物FE的化学性质与卤素的性质相似,可与水发生反应生成卤化氢和次卤酸。试写出FE与水发生反应的化学方程式__________________________。
【答案】N2O5 NO HClO4>HBrO4 Na2O2电子式![]() BrCl + H2O == HBrO + HCl
BrCl + H2O == HBrO + HCl
【解析】
根据元素在周期表中的位置可知:A为N,B为Na,C为O,D为S,E为Cl,F为Br。
(1)N元素位于第VA族,最高正价为+5价,氮的氧化物中氧元素显-2价,所以其最高价氧化物的化学式为N2O5。
(2)单质N2与O2在放电时形成的化合物为NO。
(3)非金属性越强,最高价氧化物的水化物酸性越强,非金属性Cl>Br,则F、E元素最高价氧化物对应的水化物酸性: HClO4>HBrO4。
(4)Na在O2中燃烧形成化合物是过氧化钠,电子式表示为![]() 。
。
(5)化合物BrCl的化学性质与卤素的性质相似,可与水发生反应生成卤化氢和次卤酸,反应的化学方程式为BrCl + H2O = HBrO + HCl。


 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:
【题目】下图是实验室制备氯气并进行一系列相关实验的装置(夹持设备和A中加热装置已省略)。
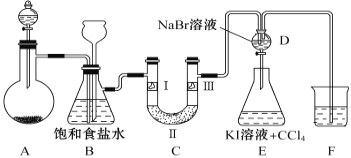
请回答:
(1)制备氯气选用的药品为固体二氧化锰和浓盐酸,相关反应的化学方程为________________。
(2)装置B中饱和食盐水的作用是____________。同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象___________________________________。
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入_______。
选项 | Ⅰ | Ⅱ | Ⅲ |
A | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
B | 干燥的有色布条 | 硅胶 | 湿润的有色布条 |
C | 湿润的有色布条 | 浓硫酸 | 干燥的有色布条 |
D | 湿润的有色布条 | 无水氯化钙 | 干燥的有色布条 |
(4)装置F烧杯中盛放的试剂是_______________。
(5)设计装置D、E的目的是比较Cl2、Br2、I2的氧化性强弱。当向D中缓缓通入足量氯气时,可以看到无色溶液逐渐变为橙黄色,说明Cl2的氧化性大于Br2。打开装置D的活塞,将装置D中少量溶液加入装置E中,振荡,观察到的现象是________________________________________。该现象_____________(填“能”或“不能”)说明Br2 的氧化性强于I2 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50mL 18mol/L的硫酸中加入足量的铜片并加热,被还原的硫酸的物质的量
A. 小于0.45mo1B. 等于0.45molC. 在0.45mol和0.9mol之间D. 大于0.9mo1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中草药秦皮中含有的七叶树内酯(每个折点表示一个碳原子,氢原子未画出),具有抗菌作用。若1 mol七叶树内酯分别与浓溴水和NaOH溶液完全反应,则消耗的Br2和NaOH的物质的量分别为( )
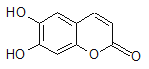
A、2 mol Br2 2 mol NaOH
B、2 mol Br2 3 mol NaOH
C、3 mol Br2 4 mol NaOH
D、4 mol Br2 4 mol NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关科学家及其创建理论的描述中,错误的是( )
A. 汤姆生提出葡萄干面包式模型 B. 道尔顿创立分子学说
C. 门捷列夫发现了元素周期律 D. 卢瑟福提出了核式原子模型
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,水作还原剂的是
A. 2H2O+2F2=4HF+O2 B. 2Na2O2+2H2O=4NaOH+O2↑
C. 2Na+2H2O=2NaOH+H2↑ D. 2H2O2 ![]() 2H2O+O2↑
2H2O+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 用湿润的pH试纸测定NaCl 溶液的pH时会影响测定结果
B. 检验某溶液含有NH4+:取试样少许于试管中,加入足量NaOH溶液加热,用湿润红色石蕊试纸检验变蓝
C. 液溴保存时液面覆盖一层水,装在带橡胶塞的细口试剂瓶中
D. 配制一定物质的量浓度的NaOH溶液时,NaOH固体溶解后未恢复到室温就定容,所配制的溶液浓度偏小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸乙酯有四种常见的合成方法。己知A是一种单糖,广泛存在于带甜味的水果中,B是一种生活中常见的含氧有机物且式量为46,E是一种石油裂解产物,能做水果的催熟剂。它们之间的转化关系如下图:

请回答:
(1)有机物E中含有的官能团名称是________________ 。
(2)反应④的反应类型是__________________ 。
(3)有机物B在催化剂的作用下可直接转化为乙酸乙酯和另外一种常见气体,请写出该反应的化学方程式___________。
(4)下列说法正确的是___________。
A.有机物A不能使碘水变蓝
B.反应⑤是同分异构体之间的相互转换
C.有机物B、D和乙酸乙酯都是挥发性无色液体,可以通过闻气味进行鉴别
D.等质量的有机物A、D和乙酸乙酯充分燃烧,消耗氧气的质量也相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2018年1月复旦大学魏大程团队在石墨烯量子点研究领域取得重要进展。该项研究在未来光学和光电器件方面具有目大潜力。下面有关碳的叙述正确的是
A. 石墨与C60互为同位素 B. 金刚石是碳元素的一种核素
C. 13C与14C是两种不同的原子 D. 12C与C60为同素异形体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com