
(1)下列7种固态物质:P4(白磷)、NH4Cl、Ca(OH)2、NaF、CO2、金刚石,回答下列问题(填写化学式或名称):
①熔化时不需要破坏化学键的是___ _____,熔化时需要破坏共价键的是_____ ___;
②晶体中既有离子键又有共价键的是_____ ___。
③P4(白磷)、SiO2、NaF、CO2四种晶体熔点由高到低的顺序为_____ ___。
(2)某元素最高正化合价为+6,其最低负价为_____ ___。某元素R与氢形成的气态氢化物的化学式为RH3,其最高价氧化物的化学式为____ ____。
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2013-2014福建省宁德市高三5月质检理综化学试卷(解析版) 题型:实验题
(14分)某课外学习小组为探究硫酸亚铁晶体(FeSO4·7H2O)制备及影响因素,进行如下实验。
Ⅰ 制取硫酸亚铁溶液
称取一定量铁屑,放入烧瓶中,加入25 mL 3 mol·L-1 硫酸,用酒精灯加热。
(1)加热一段时间后,发现烧瓶中溶液变黄并产生能使品红溶液褪色的气体。产生该现象的原因是
(用化学方程式表示)。
(2)制备过程中,铁需过量的原因是 。
Ⅱ 实验改进
该小组同学发现以上实验不完善,查阅资料后,对实验做如下
改进:①反应前通入氮气;②水浴加热,控制温度50~60℃;
③实验中适当补充硫酸调节pH=2;④增加尾气吸收装置。改进装置如图(夹持和加热装置略去)。
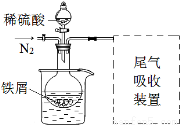
(3)实验中采用水浴加热,除了便于控制温度外,还有的优点是 。
(4)调节pH=2目的是 。
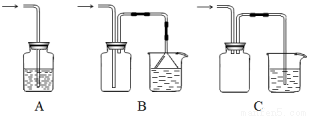
(5)下列装置适合尾气吸收的是 (填序号)。
Ⅲ 晶体纯度测定
(6)烧瓶中的溶液经处理得硫酸亚铁晶体。准确称取晶体 0.5000 g置于锥形瓶中,加入10 mL 3 mol·L-1硫酸溶液和15 mL新煮沸过的蒸馏水进行溶解,立即用0.02000 mol·L-1高锰酸钾标准溶液滴定,消耗标准溶液体积的平均值为16.90 mL。(已知:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O)
①高锰酸钾标准溶液应盛装在 滴定管(填“酸式”或“碱式”)。
②获得硫酸亚铁晶体的纯度为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省南平市毕业班质量检查理综化学试卷(解析版) 题型:选择题
下列选项合理的是( )
A.pH皆等于3 的两种溶液都稀释100倍后,pH都为5
B.10mL 0.02mol/L HCl溶液与10mL 0.02mol/L Ba(OH) 2溶液充分混合,若混合后溶液的体积为20mL,则溶液的pH=7
C.在0.1mol/L某二元弱酸强碱盐NaHA溶液中,c(Na+)=2c(A2-)+c(HA-)+c(H2A)
D.室温下,在一定量稀氨水中逐滴滴入稀盐酸,对于所得溶液中离子浓度大小关系
可能是:c(NH4+)>c(Cl—)>c(OH—)>c(H+)
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省高二下学期期末考试化学试卷(解析版) 题型:选择题
用石墨做电极电解足量CuSO4溶液。通电一段时间后,欲使用电解液恢复到初始状态,可向溶液中加入适量的
A.CuSO4 B.CuO
C.H2O D.CuSO4·5H2O
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省高二下学期期末考试化学试卷(解析版) 题型:选择题
下列物质中,按只有氧化性、只有还原性、既有氧化性又有还原性的顺序排列的一组是
A.F2、K、HCl B.Cl2、Al、H2
C.SO2、Na、Br2 D.O2、SO2、H2O
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省高一下学期期末考试化学试卷(解析版) 题型:选择题
元素A和B的原子序数都小于18。已知A元素原子的最外层电子数为a,次外层电子数为b;B元素原子的M层电子数为(a-b),L层电子数为(a+b),则A、B两元素所形成的化合物的晶体类型为( )
A.分子晶体 B.离子晶体 C.原子晶体 D.金属晶体
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省高一下学期期末考试化学试卷(解析版) 题型:选择题
下列反应中,属于取代反应的是( )。
A.CH2===CH2+H2O → CH3CH2OH B.C4H10 C2H4+ C2H6
C2H4+ C2H6
C.CH3CH3+Br2 CH3CH2Br+HBr D.2C2H2+502
CH3CH2Br+HBr D.2C2H2+502 4C02+2H20
4C02+2H20
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省三明市三校高三下学期联考理综化学试卷(解析版) 题型:简答题
(10分)工业上以黄铁矿为原料生产硫酸主要分为三个阶段进行,即煅烧、催化氧化、吸收。请回答下列个问题:
(1)煅烧黄铁矿形成的炉气必须经除尘、洗涤、干燥后进入 (填设备名称)
(2)催化氧化阶段反应2SO2(g)+O2(g)  2SO3(g) ;△H<0,550 ℃时,SO2转化为SO3的平衡转化率(α)与体系总压强(p)的关系如图所示。
2SO3(g) ;△H<0,550 ℃时,SO2转化为SO3的平衡转化率(α)与体系总压强(p)的关系如图所示。
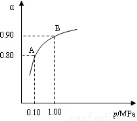
理论上要提高SO2的转化率,反应的条件应是 温 、高压(填“高”、“低”、或“常” ),但通常情况下工业生产中采用常压的原因是 。
将2.0 mol SO2和1.0 mol O2置于5 L密闭容器中,反应达平衡后,体系总压强为0.10 M Pa。该反应的平衡常数等于 。
(3)为循环利用催化剂,科研人员最新研制了一种离子交换法回收钒的新工艺,回收率达91.7%以上。已知废钒催化剂中含有V2O5、VOSO4及不溶性残渣。查阅资料知:VOSO4可溶于水,V2O5难溶于水,NH4VO3难溶于水。该工艺的流程如下图。
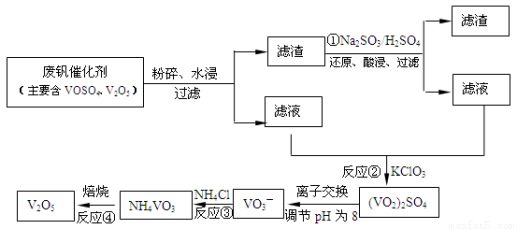
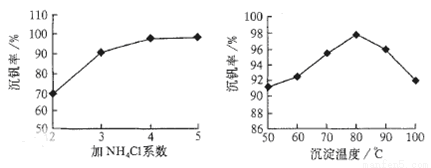
则:反应①②③④中属于氧化还原反应的是 (填数字序号),反应③的离子方程式为 。该工艺中反应③的沉淀率(又称沉矾率)是回收钒的关键之一,沉钒率的高低除受溶液pH影响外,还需要控制氯化铵系数(NH4Cl加入质量与料液中V2O5的质量比)和温度。根据下图试建议控制氯化铵系数和温度: 、 。
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省“四地六校”下学期第三次联考高一化学试卷(解析版) 题型:选择题
对于可逆反应2SO2+O2 2SO3,在混合气体中充入一定量的18O2,足够长的时间后,18O原子 ( )
2SO3,在混合气体中充入一定量的18O2,足够长的时间后,18O原子 ( )
A.只存在于O2中 B.只存在于O2和SO3中
C.只存在于O2和SO2中 D.存在于O2、SO2和SO3中
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com