
为了将混有K2SO4、MgSO4的KNO3固体提纯,并制得纯净的KNO3溶液,某学生设计 如下实验方案:
如下实验方案:

(1)操作①为___________________________________________________________。
(2)操作②~④加入的试剂依次可以为:___________________________________
_____________________________________________________________________。
(3)如何判断SO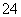 已除尽?______________________________________________
已除尽?______________________________________________
____________________________________________________________________。
(4)实验过程中产生的多次沉淀________(填“需要”或“不需要”)多次过滤,其理由是_________________________________________________________________________。
(5)该同学的实验设计方案是否严密?请说明理由:__________________________
________________________________________________________________________。
解析 沉淀反应必须在溶液中进行,以便充分反应,并使杂质完全沉淀,所以首先应当将固体配制成溶液。除去SO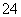 、Mg2+的方法一般是使它们分别形成BaSO4和Mg(OH)2沉淀,所以需要加入稍过量的Ba(NO3)2和KOH溶液,过量的Ba2+可用K2CO3溶液除去,因此实验时必须先加入Ba(NO3)2溶液,后加入K2CO3溶液,同时要注意不可加入BaCl2、Na2CO3和NaOH溶液进行除杂,也不可用稀盐酸调节溶液的pH,否则会引进Na+和Cl-杂质。
、Mg2+的方法一般是使它们分别形成BaSO4和Mg(OH)2沉淀,所以需要加入稍过量的Ba(NO3)2和KOH溶液,过量的Ba2+可用K2CO3溶液除去,因此实验时必须先加入Ba(NO3)2溶液,后加入K2CO3溶液,同时要注意不可加入BaCl2、Na2CO3和NaOH溶液进行除杂,也不可用稀盐酸调节溶液的pH,否则会引进Na+和Cl-杂质。
答案 (1)加水溶解 (2)Ba(NO3)2、K2CO3、KOH或KOH、Ba(NO3)2、K2CO3或Ba(NO3)2、KOH、K2CO3 (3)静置,在上层澄清溶液中再加入少量Ba(NO3)2溶液,若不变浑浊,表明SO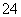 已除尽 (4)不需要 几个沉淀反应互不干扰,因此最后只过滤一次,可减少操作程序 (5)不严密,因为加入盐酸调节溶液的pH会引入Cl-,应加入稀硝酸
已除尽 (4)不需要 几个沉淀反应互不干扰,因此最后只过滤一次,可减少操作程序 (5)不严密,因为加入盐酸调节溶液的pH会引入Cl-,应加入稀硝酸


科目:高中化学 来源: 题型:
设NA代表阿伏伽德罗常数,下列说法正确的是
A.1mol Mg Cl2中含有的离子数为2NA‘
B.标准状况下,11.2L H2O中含有的原子数为1.5NA
C.标准状况下,22.4L氦气与22.4L氯气所含原子数均为2NA
D.常温下,2.7g铝与足量的盐酸反应,失去的电子数为0.3 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
下列盛放试剂的方法正确的是
A.氢氟酸或浓硝酸存放在带橡胶塞的棕色玻璃瓶中
B.汽油或煤油存放在带橡胶塞的棕色玻璃瓶中
C.碳酸钠溶液或氢氧化钙溶液存放在配有磨口塞的棕色玻璃瓶中
D.氯水或硝酸银溶液存放在配有磨口塞的棕色玻璃瓶中
查看答案和解析>>
科目:高中化学 来源: 题型:
按以下实验方案可从海洋动物柄海鞘中提取具有抗肿瘤活性的天然产物。
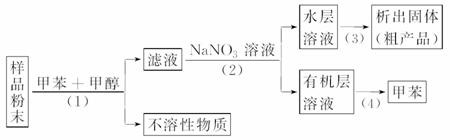
下列说法错误的是
A.步骤(1)需要过滤装置
B.步骤(2)需要用到分液漏斗
C.步骤(3)需要用到坩埚
D.步骤(4)需要蒸馏装置
查看答案和解析>>
科目:高中化学 来源: 题型:
有下列三种含杂质的气体(括号内为杂质):①CO2(HCl) ②H2(HCl) ③NH3(水蒸气)。某学生欲除去以上气体中的杂质依次选用了三种试剂,该学生选用的试剂均正确的是
A.NaHCO3溶液、NaOH溶液、碱石灰
B.Na2CO3溶液、浓硫酸、碱石灰
C.NaHCO3溶液、NaOH溶液、浓硫酸
D.NaOH溶液、浓硫酸、碱石灰
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究小组为测定食用白醋中醋酸的含量进行了如下操作,其中正确的是( )
A.用碱式滴定管量取一定体积的待测白醋放入锥形瓶中
B.称取4.0 g NaOH到1 000 mL容量瓶加水至刻度,配成1.00 mol·L-1 NaOH标准溶液
C.用NaOH溶液滴定白醋,使用酚酞作指示剂,溶液颜色恰好由无色变为浅红色,且半分钟内不褪色时,为滴定终点
D.滴定时眼睛要注视着滴定管内NaOH溶液的液面变化,防止滴定过量
查看答案和解析>>
科目:高中化学 来源: 题型:
铁及其化合物在日常生活中应用广泛,请根据下列实验回答问题:
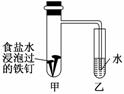 (1)钢铁的腐蚀
(1)钢铁的腐蚀
钢铁在潮湿的空气中被腐蚀的负极反应式为______________________;将经过酸洗除锈的铁钉,用饱和食盐水浸泡后,放入如图所示装置中,下列叙述正确的是________。
A.过一段时间,乙试管中的导管内水柱上升
B.甲试管中铁钉发生了化学腐蚀
C.铁钉在该装置中被腐蚀的情况随时间的延长而加快
(2)生铁中含有一种铁碳化合物X(Fe3C)。X在足量的空气中高温煅烧,生成有磁性的固体Y,将Y溶于过量盐酸的溶液中含有的大量阳离子是________;X与过量浓硝酸反应后溶液中含有的盐的化学式为________。
(3)氧化铁是重要的工业颜料,用废铁屑制备它的流程如下:
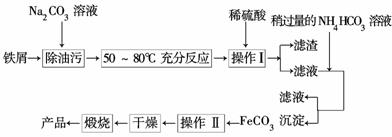
回答下列问题:
①操作Ⅰ的名称是__________________,操作Ⅱ的名称是________________;
②Na2CO3溶液可以除油污,原因是(用离子方程式表示)
________________________________________________________________________;
③请完成生成FeCO3沉淀的离子方程式:
Fe2++HCO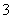 ——____________________。
——____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某短周期非金属元素的原子核外最外层电子数是次外层电子数的一半,该元素
A.在自然界中只以化合态的形式存在
B.单质常用作半导体材料和光导纤维
C.最高价氧化物不与酸反应
D.气态氢化物比甲烷稳定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com