
【题目】A、B、C、D四种芳香族化合物都是某些植物挥发油中主要成分,有的是药物,有的是香料。它们的结构简式如下所示:
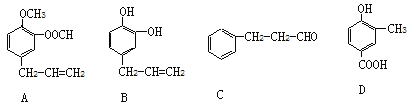
(1)写出上述有机物A中官能团的名称_______________________________________。
(2)能与新制Cu(OH)2反应的有________________________(用A、B、C、D填写)。写出含碳原子数较少的物质与新制Cu(OH)2反应生成砖红色沉淀的化学反应方程式:________________________________
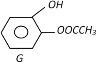
(3)① D一种同分异构体G的结构简式如上图:写出G与足量NaOH溶液共热反应方程式:_____________
② D的另一种同分异构体H,其苯环上有两个相邻的取代基,它既能使FeCl3溶液变紫色,又能与NaHCO3溶液反应放出CO2气体,H的结构简式是______________________________。
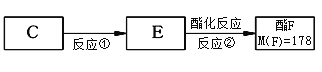
(4)按上图,C经一步反应可生成E,E是B的同分异构体,则反应①属于__________反应,F结构简式_______________________________。
【答案】醚键、酯基、碳碳双键 A、C、D 略 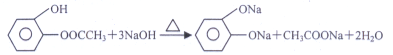
 氧化
氧化 ![]()
【解析】
(1)仔细观察A的结构,找到官能团;
(2)官能团存在醛基、-COOH均能与新制Cu(OH)2反应;
(3)①仔细观察G的结构,发现能与氢氧化钠反应的官能团有酚羟基,酚酯,注意酚酯消耗氢氧化钠1:2;
② D的同分异构体H,其苯环上有两个相邻的取代基,能使FeCl3溶液变紫色,说明有酚羟基;能与NaHCO3溶液反应放出CO2气体,说明有羧基;
(4)按上图,C经一步反应可生成E,E是B的同分异构体,根据E、F相对分子质量差值确定F;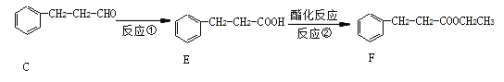
(1)仔细观察A的结构,有机物A中官能团的名称:醚键、酯基、碳碳双键;
答案: 醚键、酯基、碳碳双键
(2)官能团存在醛基、-COOH均能与新制Cu(OH)2反应;。含碳原子数较少的物质与新制Cu(OH)2反应生成砖红色沉淀的化学反应方程式: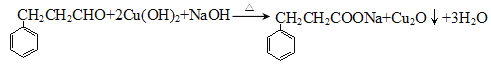 ;
;
答案:A、C、D 
(3)①仔细观察G的结构,发现能与氢氧化钠反应的官能团有酚羟基,酚酯,注意酚酯消耗氢氧化钠1:2,化学方程式为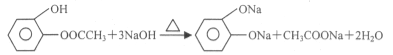 ;
;
答案: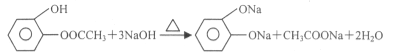
② D的另一种同分异构体H,其苯环上有两个相邻的取代基,它既能使FeCl3溶液变紫色,说明有酚羟基,又能与NaHCO3溶液反应放出CO2气体,说明有羧基,H的结构简式是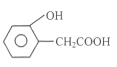 ;
;
答案: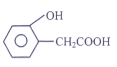
(4)按上图,C经一步反应可生成E,E是B的同分异构体,根据E、F相对分子质量差值为28,确定F;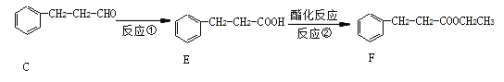
答案: 氧化 (7). ![]()


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】电解NO制备NH4NO3的工作原理如图所示,X、Y皆Pt电极,为使电解产物全部转化为NH4NO3,需补充物质A。下列说法正确的是( )
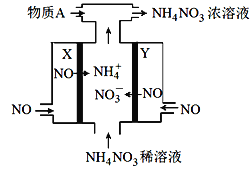
A. 物质A为NH3
B. X电极为电解池阳极
C. Y电极上发生了还原反应
D. Y电极反应式:NO-3e-+ 4OH-===NO3- +2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组的同学用如图所示装置研究有关电化学的问题。当闭合该装 置的开关时,观察到电流表的指针发生了偏转。

请回答下列问题:
(1)甲池为_____(填“原电池”“电解池”或“电镀池”),通入 CH3OH 电极的电极反应为_____。
(2)乙池中 A(石墨)电极的名称为_____(填“正极”“负极”或“阴极”“阳极”),总反应为__________。
(3)若甲、乙、丙溶液体积均为500 mL,当乙池中 B 极质量增加 5.4 g 时,甲池中理论上消耗 O2 的体积为_____mL(标准状 况),乙池中溶液PH=_______,丙池中_____(填“C”或“D”)极析出_____g 铜。
(4)若丙中电极不变,将其溶液换成 NaCl 溶液,开关闭合一段时间后,甲中溶液的 pH将_____(填“增大”“减小”或“不变”,下同),丙中溶液的 pH 将______。
(5)某溶液中可能含有下列离子中的两种或几种:Ba2+、H+、SO42-、 SO32- 、HCO3-、 Cl-。
①当溶液中有大量H+存在时,则不可能有_______________________离子存在。
②当溶液中有大量Ba2+存在时,溶液中不可能有_________________离子存在。
③采用惰性电极从上述离子中选出适当离子组成易溶于水的电解质,对其溶液进行电解若两极分别放出气体,且体积比为1∶1,则电解质化学式是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A.以电解食盐水为基础制取氯气等产品的工业称为“氯碱工业”
B.在通常情况下,氯气是一种有刺激性气味、有毒、极易溶于水且密度比空气大的黄绿色气体
C.液氯、氯水和漂白粉都是混合物
D.Cl2和Cl-的性质十分相似
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锑(Sb)在自然界一般以硫化物的形式存在,我国锑的蕴藏量占世界第一。从硫化物中提取单质锑一般是先在高温下将硫化物转化为氧化物,再用碳还原:2Sb2S3+3O2+6Fe=Sb4O6+6FeS①;Sb4O6+6C=4Sb+6CO②。下列说法正确的是( )
A. 反应②说明高温下Sb还原性比C强
B. 反应①中每生成1 mol FeS时,共转移2mol电子
C. 每生成1 mol Sb时,反应①与反应②中还原剂的物质的量之比为4︰3
D. 反应①②中氧化剂分别是Sb2S3、Sb4O6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各关系式中能说明反应N2+3H2![]() 2NH3已达到平衡状态的是( )
2NH3已达到平衡状态的是( )
A. 3v正(N2)=v正(H2) B. v正(N2)=v逆(NH3)
C. 2v正(H2)=3v逆(NH3) D. v正(N2)=3v逆(H2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出下列物质的电离方程式:
①H2SO4: ________
②NaOH: ________
③Fe2(SO4)3: ________
(2)写出下列化学反应的离子方程式:
①氢氧化钠与盐酸反应:________
②铁片与硫酸的反应:________
③硫酸铜与氢氧化钡的反应:________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2SO2 (g)+O2 (g)![]() 2SO3 (g) ΔH=-197 kJ·mol-1。向同温、同体积的三个密闭容器中分别充入气体:(甲) 2 mol SO2和1 mol O2;(乙) 1 mol SO2和0.5 mol O2 ;(丙) 2 mol SO3 。恒温、恒容下反应达平衡时,下列关系一定正确的是( )
2SO3 (g) ΔH=-197 kJ·mol-1。向同温、同体积的三个密闭容器中分别充入气体:(甲) 2 mol SO2和1 mol O2;(乙) 1 mol SO2和0.5 mol O2 ;(丙) 2 mol SO3 。恒温、恒容下反应达平衡时,下列关系一定正确的是( )
A. 容器内压强p:p甲=p丙>2p乙
B. SO3的质量m:m甲=m丙>2m乙
C. c(SO2)与c(O2)之比为k:k甲=k丙>k乙
D. 反应放出或吸收热量的数值Q:Q甲=Q丙>2Q乙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在-50℃时液氨中存在着下列平衡:2NH3(液)![]() NH4++NH2-,两种离子的平衡浓度均为1.0×10-15mol·L-1。以下有关-50℃时离子积的叙述中正确的是( )
NH4++NH2-,两种离子的平衡浓度均为1.0×10-15mol·L-1。以下有关-50℃时离子积的叙述中正确的是( )
A. 离子积为1.0×10-15
B. 离子积为1.0×10-30
C. 向液氨中加入氨基钠(NaNH2),液氨的离子积增大
D. 向液氨中加入NH4Cl,c(NH4+)增大,离子积的数值也随之增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com