
����Ŀ����ͼ��ʾ����֧�缫��Ϊ���缫����ѡ�������������Һ���±���
�� | A | B | C | D |
�ײ� | NaOH��Һ | AgNO3��Һ | H2SO4��Һ | NaCl��Һ |
�Ҳ� | CuSO4��Һ | CuCl2��Һ | AgNO3��Һ | AgNO3��Һ |
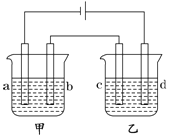
Ҫ����������ǣ��ٹ���һ��ʱ��ײ۵��ҺpH���������Ҳ۵��ҺpH�½�����b��c�����ŵ����ӵ����ʵ�����ȡ���
(1)Ӧѡ�õĵ��Һ��________�顣
(2)�ײ۵ĵ�ⷽ��ʽΪ��_____________���Ҳ۵ĵ�ⷽ��ʽΪ��_______________��
���𰸡�D 2NaCl��2H2O![]() 2NaOH��Cl2����H2�� 4AgNO3��2H2O
2NaOH��Cl2����H2�� 4AgNO3��2H2O![]() 4Ag��O2����4HNO3
4Ag��O2����4HNO3
��������
������һ��ʱ���ײ�pH�������Ҳ۵�pH�½�����b��c�����Ϸ�Ӧ�����ӵ����ʵ�����ȡ����Ե缫��⣻
A�顢�ײ��ǵ��ˮ������������ҺpH����b�缫���������缫��ӦΪ��4OH��-4e��=2H2O+O2�����Ҳ۵������ͭ��Һ����ҺpH��С��c�缫Ϊ��������ⷴӦΪ��Cu2��+2e��=Cu�����ݵ����غ��֪��b��c�����Ϸ�Ӧ�����ӵ����ʵ�������ȣ�
B�顢�ײ��ǵ������������ҺpH��С��b�缫���������缫��ӦΪ��4OH��-4e��=2H2O+O2�����Ҳ۵���Ȼ�ͭ��Һ����ҺpH��С��c�缫Ϊ��������ⷴӦΪ��Cu2��+2e��=Cu�����ݵ����غ��֪��b��c�����Ϸ�Ӧ�����ӵ����ʵ�������ȣ�
C�顢�ײ��ǵ��ˮ��������ҺpH��С��b�缫���������缫��ӦΪ��4OH��-4e��=2H2O+O2�����Ҳ۵����������Һ����ҺpH��С��c�缫Ϊ��������ⷴӦΪ��4Ag��+4e��=4Ag�����ݵ����غ��֪��b��c�����Ϸ�Ӧ�����ӵ����ʵ�����ȣ�
D�顢�ײ��ǵ���Ȼ��ƣ��Ȼ�����ҺpH����b�缫���������缫��ӦΪ��4OH��-4e��=2H2O+O2�����Ҳ۵����������Һ����ҺpH��С��c�缫Ϊ��������ⷴӦΪ��4Ag��+4e��=4Ag�����ݵ����غ��֪��b��c�����Ϸ�Ӧ�����ӵ����ʵ�����ȣ�
���ݵ缫��Ӧ�͵缫��������ҺpH�仯�����жϡ�
��1����������������֪��������������D�飻
��2���ײ۵��ʳ��ˮ�����������ơ��������������ײ۵ĵ�ⷽ��ʽΪ��2NaCl��2H2O![]() 2NaOH��Cl2����H2�����Ҳ۵����������Һ�����������������ᣬ�Ҳ۵ĵ�ⷽ��ʽΪ��4AgNO3��2H2O
2NaOH��Cl2����H2�����Ҳ۵����������Һ�����������������ᣬ�Ҳ۵ĵ�ⷽ��ʽΪ��4AgNO3��2H2O![]() 4Ag��O2����4HNO3��
4Ag��O2����4HNO3��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͨ��������_________�У�����ʱ���ƿ����ڿ�����_________������________���棬����____________ɫ���塣��ѧ����ʽΪ________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ�������Ϊ100mL��Ũ�Ⱦ�Ϊ������һԪ��MOH��ROH����Һ�У��ֱ�ͨ��HCl���壬![]() ��ͨ��HCl�����ʵ����ı仯��ͼ��ʾ�������й�˵���в���ȷ���ǣ���������Һ����ı仯���� ��
��ͨ��HCl�����ʵ����ı仯��ͼ��ʾ�������й�˵���в���ȷ���ǣ���������Һ����ı仯���� ��
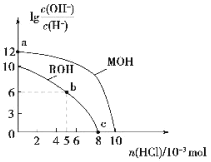
A.MOH��ǿ�ROH������
B.a����ˮ���������c(H+)��c(OH-)�ij˻�Ϊ1��10-26
C.b����Һ�У�c(Cl-)>c(R+)>c(H+)>c(OH-)
D.c����Һ��pH=7������������ΪROH��RCl
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����.��ѧ��Դ���������������Ź㷺��Ӧ�ã��綯�������õ�Ǧ��������һ���������״̬ͭ��Ǧ�����һ��ṹ���Ƶij���������Ǧ��Ǧ����ɣ���H2SO4�����Һ���ŵ�ʱ�ܷ�ӦΪ��Pb + PbO2 + 2H2SO4 = 2PbSO4 + 2H2O
��1��д���ŵ�ʱ�����ĵ缫��Ӧʽ��___��
��2��Ǧ���طŵ�ʱ����Һ��pH��_________������������������С���������������������·����0.5mol����ͨ��ʱ����Һ������H2SO4�����ʵ���Ϊ___________��
��3���ŵ���Ըõ�ؽ��г�磬�����ӵ�Դ�ĸ���һ������________��(����Pb������PbO2��)
��.����ϰ���ϰѵ�ⱥ��ʳ��ˮ�Ĺ�ҵ�����ȼҵ������ͼ��ʾ��ⱥ��NaCl��Һ��װ�ã�X��Y��ʯī����ʵ�鿪ʼʱ��������ͬʱ�����뼸�η�̪��Һ����ش��������⣺
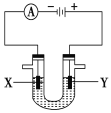
��4��X���ϵĵ缫��Ӧʽ�ǣ�__________��
��5������Y�缫��Ӧ����ķ�����_______��
��6����ⱥ��NaCl��Һ�����ӷ���ʽ�ǣ�___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ�������
A. �Ҵ�ȼ�������������������ڷ�Ӧ���������ķ�Ӧ
B. ϡ��Һ�У�H+��aq��+OH����aq��=H2O��l����H=��57.3 kJ/mol�ɱ�ʾϡ������ϡBa��OH��2��Һ��Ӧ���к���Ϊ��H=��57.3 kJ/mol
C. 2H2S��g��+3O2��g��=2SO2��g��+2H2O��l����H=��QkJ/mol���Ա�ʾH2S��ȼ����
D. �����£�ij��Ӧ�ﵽƽ�⣬ƽ�ⳣ��ΪK=![]() ������ʱ���¶����ߣ�H2Ũ�ȼ�С���ʸ÷�Ӧ���ʱ�Ϊ��ֵ
������ʱ���¶����ߣ�H2Ũ�ȼ�С���ʸ÷�Ӧ���ʱ�Ϊ��ֵ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й����Ȼ�ѧ��Ӧ����������ȷ����
A. HCl��NaOH��Ӧ���к�����H����57.3kJ/mol����H2SO4��Ca(OH)2��Ӧ���к�����H��2��(��57.3)kJ/mol
B. CO(g)��ȼ������283.0kJ/mol����2CO2(g) ��2CO(g)��O2(g)��Ӧ����H��+2��283.0kJ/mol
C. ��Ҫ���Ȳ��ܷ����ķ�Ӧһ�������ȷ�Ӧ
D. 1mol����ȼ��������̬ˮ�Ͷ�����̼���ų��������Ǽ����ȼ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��pBa����lgc(Ba2��)��Ksp(BaSO4)��1.0��10-10��Ksp(BaCO3)��3.0��10-9�������£��� 0.1 mol��L-1Na2SO4��Һ�ζ� 20 mL 0.1 mol��L-1BaCl2��Һ��������ͼ��ʾ��V0�ﵽ�ζ��յ㣬����˵���������
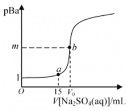
A.ͼ���У�m��5��V0��20
B.����c(BaCl2)�� 0.1 mol�� L-1��Ϊ 0.2 mol�� L-1��m ֵ����С
C.a ����Һ������Ũ�ȴ�С��ϵΪ��c(Cl-)��c(Na+)��c(Ba2+)��c(OH-)
D.��b����Һ�еμ�Na2CO3��Һ��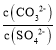 ��30 ʱ������BaCO3
��30 ʱ������BaCO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��п�����ú�ZnO���̳��ѳ����Ṥ�������е�SO2��ZnSO4��
��֪����ZnSO3��![]() H2O����ˮ��ZnSO4������ˮ��
H2O����ˮ��ZnSO4������ˮ��
��25��ʱ����Һ��S��+4�ۣ�����ֵ����ʵ���������pH�仯��������ͼ��
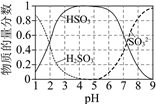
��O3Ϊǿ��������1 mol O3����ԭת��2 mol e��ͬʱ����1 mol O2��
(1)SO2��ɵĻ���������Ҫ��_____________________��
(2)ZnO��SO2ת��ΪZnSO3��![]() H2O�Ļ�ѧ����ʽ��_____________________________��
H2O�Ļ�ѧ����ʽ��_____________________________��
(3)��ZnSO3��![]() H2O����Һת��ΪZnSO4ʱ�����䱻O2���������ʺ���������ɹܵ�������ʵ����ģ��O3������������⡣��ʼʱ�����Ὣ5% ZnSO3����Һ���� pH��3.5����һ���Ľ�������ͨ��O3���о�O3����ZnSO3��
H2O����Һת��ΪZnSO4ʱ�����䱻O2���������ʺ���������ɹܵ�������ʵ����ģ��O3������������⡣��ʼʱ�����Ὣ5% ZnSO3����Һ���� pH��3.5����һ���Ľ�������ͨ��O3���о�O3����ZnSO3��![]() H2O��������ҺpH��ʱ��仯���������£�
H2O��������ҺpH��ʱ��仯���������£�

��pH��3.5����Һ�к�S��+4�ۣ���������Ҫ��____________________��
��һ��ʱ�����Һ��pH��С���˹�������Ҫ��Ӧ�����ӷ���ʽ��________________��
�۽���O3�����ɷ�ֹ�ܵ�������ԭ��___________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com