


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、电解精炼铜时,同一时间内阳极溶解铜的质量比阴极析出铜的质量小 |
| B、合成氨工业中,将NH3及时液化分离有利于加快反应速率 |
| C、硫酸工业中,采用常压条件的原因是此条件下催化剂活性最高 |
| D、侯氏制碱是将CO2和NH3先后通入饱和氯化钠溶液中得碳酸氢钠固体,再灼烧制碳酸钠固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
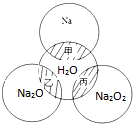 如图所示,两圆圈相交的阴影部分甲乙丙表示圆圈内物质相互发生反应,钠及其氧化物的物质的量均为0.1mol.水的质量为100g,下列说法正确的是( )
如图所示,两圆圈相交的阴影部分甲乙丙表示圆圈内物质相互发生反应,钠及其氧化物的物质的量均为0.1mol.水的质量为100g,下列说法正确的是( )| A、甲乙丙反应都属于氧化还原反应 |
| B、丙反应中的氧化剂是Na2O2,还原剂是H20 |
| C、丙反应中若消耗1molNa2O2,则转移2moL的电子 |
| D、甲乙丙反应后所得溶液的质量分数分别为ω1、ω2、ω3,则2ω1>ω2=ω3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验序号 | a | b | c |
| 合金质量/mg | 510 | 765 | 918 |
| 气体体积/mL | 560 | 672 | 672 |
查看答案和解析>>
科目:高中化学 来源: 题型:
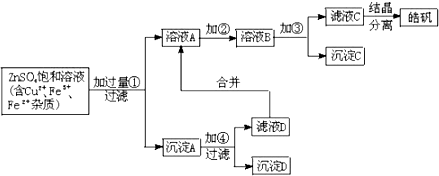
查看答案和解析>>
科目:高中化学 来源: 题型:
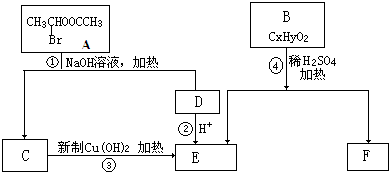
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、配制酸性KMnO4溶液时,用盐酸酸化 |
| B、用水湿润pH试纸测量某溶液的pH值 |
C、实验室用右图所示装置除去Cl2中的少量HCl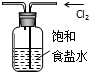 |
| D、用盐酸标准溶液滴定待测的氢氧化钠溶液时,水洗后的酸式滴定管未经标准液润洗,则测定结果偏低 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com