
【题目】某小组同学通过“FeSO4被浓HNO3氧化”的实验,验证Fe2+的还原性。
实验一:验证Fe2+的还原性
实验操作 | 预期现象 | 实验现象 |
向盛有2 mL FeSO4溶液的试管中,滴入几滴浓硝酸,振荡 | 试管中产生红棕色气体,溶液变为黄色 | 试管中产生红棕色气体,溶液变为深棕色 |
(1)红棕色气体是_______。
(2)实验现象与预期不符,继续进行实验。
取深棕色溶液于试管中,滴加KSCN溶液,溶液变为红色,该现象说明_______。
实验二:探究溶液变为深棕色的原因
(资料与猜想)
查阅资料后猜想,可能是生成的NO2或NO与溶液中的Fe2+或Fe3+反应,而使溶液变为深棕色。
(实验与探究)
用下图所示装置进行实验(气密性已检验,尾气处理已略去)

i. 关闭c,打开a和b,通入N2,一段时间后关闭a;
ii. 向甲中加入适量浓HNO3,一段时间后丙中溶液变为深棕色,丁中溶液无明显变化;
iii. 关闭b、打开c,更换丙、丁中的溶液(试剂不变);
iv. 继续向甲中加入浓HNO3,一段时间后观察到了与ii相同的实验现象。
(1)通入N2的目的是________。
(2)铜与浓硝酸反应的化学方程式是________。
(3)装置乙的作用是________。
(4)实验结论是________。
(反思与改进)
实验三:验证Fe2+的还原性
该小组同学依据实验二的结论改进了实验一,观察到了预期现象,其实验操作是________。
【答案】二氧化氮Fe2+具有还原性。(答“溶液中有Fe3+”得分)排净装置内的空气。Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O使NO2转化为NO。溶液的深棕色是由于Fe2+与NO发生了反应,也可能是由于Fe2+与NO2发生了反应,不是由于Fe3+与NO或NO2发生反应。向盛有2 mL浓硝酸的试管中滴入几滴FeSO4溶液,振荡。
【解析】
实验一:(1)硝酸将Fe2+氧化为Fe3+的同时被还原生成NO,NO遇空气生成二氧化氮,故红棕色气体是二氧化氮;
(2)取深棕色溶液于试管中,滴加KSCN溶液,溶液变为红色,该现象说明Fe2+具有还原性,被氧化生成Fe3+,溶液中有Fe3+,与KSCN溶液反应使溶液变为红色;
实验二:(1)为防止产生的NO遇空气中的氧气反应生成二氧化氮,通入N2的目的是排净装置内的空气;
(2)铜与浓硝酸反应生成硝酸铜、二氧化氮和水,反应的化学方程式是Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;
(3)装置乙的作用是利用水与二氧化氮反应,使NO2转化为NO;
(4)实验结论是溶液的深棕色是由于Fe2+与NO发生了反应,也可能是由于Fe2+与NO2发生了反应,不是由于Fe3+与NO或NO2发生反应;
实验三:该小组同学依据实验二的结论改进了实验一,向盛有2 mL浓硝酸的试管中滴入几滴FeSO4溶液,振荡。


科目:高中化学 来源: 题型:
【题目】某研究性学习小组对某废旧合金(含有Cu、Fe、Si三种成分)进行分离、回收。其工业流程如下:
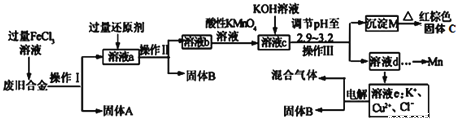
已知:298K时,Ksp[Cu(OH)2]=2.0×10-20,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Mn(OH)2]=1.9×10-13,
根据上面流程回答有关问题:
(1)操作Ⅰ、Ⅱ、Ⅲ一定都不含有的操作是________。
A.过滤B.洗涤C.干燥D.蒸馏
(2)过量的还原剂应是__________________,溶液a中发生的反应的离子方程式为________________________________。
(3)若用xmol/LKMnO4溶液处理溶液b,当恰好将溶液中的阳离子完全氧化时消耗KMnO4溶液ymL,则最后所得红棕色固体C的质量为________g(用含x、y的代数式表示)。
(4)将溶液c调节pH至2.9-3.2的目的是______________________________。
(5)常温下,取0.2mol/L的CuCl2溶液,若要使Cu2+开始沉淀,应调节pH至___________。
(6)用惰性电极电解溶液e制取固体B,所发生的化学反应方程式为___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为FeO·Cr2O3,还含有硅、铝等杂质。制备流程如图所示:

已知:铬元素在酸性条件下以重铬酸根离子的形式存在。回答下列问题:
(1)步骤①的主要反应为:FeOCr2O3+Na2CO3+NaNO3![]() Na2CrO4+Fe2O3+CO2+ NaNO2,上述反应配平后FeO·Cr2O3与NaNO3的系数比为__________。该步骤不能使用陶瓷容器,原因是_____________________________。
Na2CrO4+Fe2O3+CO2+ NaNO2,上述反应配平后FeO·Cr2O3与NaNO3的系数比为__________。该步骤不能使用陶瓷容器,原因是_____________________________。
(2)滤渣1中含量最多的金属元素是____________,滤渣2的主要成分是____________及含硅杂质。
(3)步骤④调滤液2的pH使之变____________________(填“大”或“小”),原因是________________(用离子方程式表示)。
(4)有关物质的溶解度如图所示。向“滤液3”中加入适量KCl,蒸发浓缩,冷却结晶,过滤得到K2Cr2O7固体。冷却到___________ (填标号)得到的K2Cr2O7固体产品最多。
a.80℃ b.60℃ c.40℃ d.10℃
步骤⑤的反应类型是___________________。

(5)某工厂用m1kg铬铁矿粉(含Cr2O3 40%)制备K2Cr2O7,最终得到产品m2kg,产率为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是来自石油的重要有机化工原料。结合以下路线回答:

已知:2CH3CHO+O2![]() 2CH3COOH
2CH3COOH
(1)D是高分子,用来制造包装材料,其结构简式是________。
(2)反应II的化学方程式是________。
(3)E有香味,实验室用A和C反应制取E的装置如图所示。

①反应IV的化学方程式是________,其反应类型是________。
②分离出试管乙中油状液体需要用到的仪器是________(填序号)。
a. 漏斗 b. 分液漏斗 c. 长颈漏斗
③实验结束,振荡试管乙,有无色气泡产生,其主要原因是________(用化学方程式表示)。
(4)产物CH2=CH-COOH可能发生的反应有________(填序号)。
a. 加成反应 b. 取代反应 c. 氧化反应 d. 中和反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】700℃时,H2(g)+CO2(g)![]() H2O(g)+CO(g).该温度下,在甲、乙、丙三个恒容密闭容器中,投入H2和CO2,起始浓度如下表所示.其中甲经2min达平衡时,v(H2O)为0.025mol/(Lmin),下列判断错误的是( )
H2O(g)+CO(g).该温度下,在甲、乙、丙三个恒容密闭容器中,投入H2和CO2,起始浓度如下表所示.其中甲经2min达平衡时,v(H2O)为0.025mol/(Lmin),下列判断错误的是( )
起始浓度 | 甲 | 乙 | 丙 |
c(H2)/mol/L | 0.10 | 0.20 | 0.20 |
c(CO2)/mol/L | 0.10 | 0.10 | 0.20 |
A. 平衡时,乙中CO2的转化率等于50%
B. 当反应平衡时,丙中c(CO2)是甲中的2倍
C. 温度升至800℃,上述反应平衡常数为25/16,则正反应为吸热反应
D. 其他条件不变,若起始时向容器乙中充入0.10mol/L H2和0.20 mol/LCO2,到达平衡时c (CO)与乙相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】.现有四份体积、浓度均相等的AgNO3溶液,分别与等物质的量浓度的下列溶液恰好完全反应,所需溶液体积最小的是 ()
A.ZnCl2溶液B.NaCl溶液C.CaCl2溶液D.AlCl3溶液.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据酸碱质子理论,凡是能给出质子的分子或离子都是酸,凡是能给合质子的分子或离子都是碱,按照这种理论下列物质既属于酸又属于碱的是 ( )
A. NaOH B. HCl C. NaH2PO4 D. Fe2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯醇(CH2= CH-CH2OH)可发生的化学反应有 ( )
①加成 ②氧化 ③燃烧 ④取代
A.只有①②B.只有①②③C.只有①③D.①②③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com