
����Ŀ��ijͬѧ��ͬ����Ԫ�����ʵݽ�����ʵ��ʱ���Լ������һ��ʵ�鷽��������¼���й�ʵ���������±���
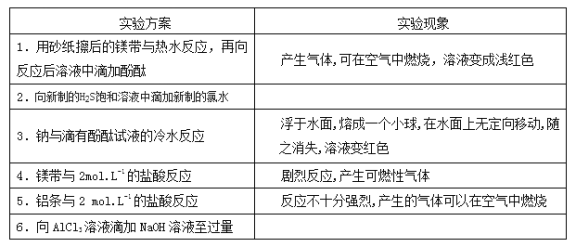
���������ͬѧ���������ʵ�鱨��
(1)ʵ��Ŀ�ģ���֤ͬ����Ԫ�ؽ����ԡ��ǽ����Եı仯���ɡ�
(2)ʵ����Ʒ���ԡ�
(3)ʵ�����ݣ�����д�����Ϣ������Ӧ��ʵ���������пո�д�����Ӧ�����ӷ���ʽ��
ʵ������ | ʵ������ | �й���������ʽ |
���� | ���� | |
�� | ______________ | ______________ |
���� | ______________ | |
�� | ���� | ���� |
�� | ���� | ______________ |
�� | ______________ | ______________ |
(4)ʵ����ۣ�______________��
(5)���������ۣ�
���ԭ�ӽṹ�����ϼ�˵�������������۵�ԭ����___________________��
���𰸡� ���ɵ���ɫ���� H2S��Cl2===2H����2Cl����S�� 2Na��2H2O===2Na����2OH����H2�� 2Al��6H��===2Al3����3H2�� ���ɰ�ɫ��״��������������ʧ Al3+ +3NH3��H2O == Al(OH)3�� + 3NH4+ ͬ����Ԫ����ԭ������������Ԫ�صĽ��������������ǽ���������ǿ ͬ����Ԫ�أ���˵���������ӣ�ԭ�Ӻ˶Ժ�����ӵ�����������ǿ��ԭ�Ӱ뾶��С��ԭ�ӵ�ʧ�����������������õ���������ǿ����Ԫ�ؽ��������������ǽ���������ǿ
����������3���������Ƶõ�Na2S��Һ���������Ƶ���ˮ��������Na2S����������ԭ��Ӧ�����ɵ���ɫ�ij�������Ӧ�����ӷ���ʽΪS2-+Cl2=2Cl-+S�����۽���������з�̪��Һ����ˮ���ҷ�Ӧ��Ѹ�ٲ���������ɫ���壬���ӷ���ʽΪ2Na +2H2O �� 2NaOH + H2�����ݽ�����Ͷ��ϡ�����У���Ӧ��ʮ�־��ң�������ɫ���壬�����ӷ�Ӧ����ʽΪ��2Al��6H��===2Al3����3H2���������Ȼ�����Һ�еμ�Ũ��ˮ��Һ���������������������������ڰ�ˮ��ʵ������Ϊ�����ɰ�ɫ��״��������������ʧ���䷴Ӧ�����ӷ���ʽΪ��Al3+ +3NH3��H2O == Al(OH)3�� + 3NH4+��
��4����ʵ�������֪������Na��Mg��Al��Ԫ�صĽ�����Խǿ����Ӧ�Ľ�������Խ���ã�Խ����ˮ���ᷴӦ����ӦԽ���ң����÷ǽ�������֮����û���Ӧ�Ƚ�Ԫ�صķǽ�����ǿ�����ǽ�����Cl��S����ͬ����Ԫ����ԭ������������Ԫ�صĽ��������������ǽ���������ǿ��
��5����ԭ�ӽṹ�ĽǶȷ�����ͬ����Ԫ�أ���˵���������ӣ�ԭ�Ӻ˶Ժ�����ӵ�����������ǿ��ԭ�Ӱ뾶��С��ԭ�ӵ�ʧ�����������������õ���������ǿ����Ԫ�ؽ��������������ǽ���������ǿ��


 ÿ��10���ӿ�����������������ϵ�д�
ÿ��10���ӿ�����������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Һ�д��������������ӣ�NO3-��SO42-�� Fe3+��H+��X�������ʵ���֮��Ϊ��n(NO3��)�Un(SO42��)�Un(Fe3+)�Un(H+)�Un(X)��2�U3�U1�U3�U1����X����Ϊ
A. Fe2+ B. Mg2+ C. Cl�� D. Ba2+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵ�����X��Y�������һ���ܱ������У���һ�������·������·�Ӧ���ﵽƽ�⣺X(g)��Y(g)![]() 2Z(g) ��H<0�����ı�ij���������ﵽ��ƽ�������������ȷ����( )
2Z(g) ��H<0�����ı�ij���������ﵽ��ƽ�������������ȷ����( )
A. �����¶ȣ�X�����������С
B. ����ѹǿ(��С�������)��Z��Ũ�Ȳ���
C. ��������������䣬����һ�����Ķ������壬Y��Ũ�Ȳ���
D. ��������������䣬����һ������Z��X�������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ij���Ľṹʾ��ͼΪ�� (y �� 0 )����ش�
(y �� 0 )����ش�
��1����x��y��10ʱ������Ϊ________(����ԭ����������������������������)��
��2����y��8ʱ��������Ϊ(������5��)___________________��
��3��д��x��y��12��x��y��16��Ԫ������������Ӧˮ�������Ӧ�����ӷ���ʽ _��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������(Na2S2O5)��һ��ʳƷ���Ӽ���ʵ��������ͼ1��ʾװ���Ʊ�Na2S2O5��ʵ�鲽�����£�

������Na2CO3��Һ��ͨ��SO2��pHΪ4.1������NaHSO3��Һ��
������̼���Ʒ�ĩ����pHΪ7��8��
������ͨSO2��pHΪ4.1��
�����ӹ�������Һ������Na2S2O5���壮
(1)�Ʊ������������ܷ�Ӧ�Ļ�ѧ����ʽΪ ��
(2)Na2S2O5����ˮ����ˮ�ܷ�Ӧ��������Һ�����ԣ���ԭ���� ���������вⶨ��Һ��pH�ķ����� ��pH��4.1ʱ�����Ʒ�л��и�����仯ѧʽ�� ��
(3)���õ������ɲⶨNa2S2O5��Ʒ��+4����ĺ�����ʵ�鷽��Ϊ����һ������Na2S2O5��Ʒ�������ƿ(��ĥ��������ƿ)�У� ���ظ����ϲ���2�Σ���¼���ݣ�(ʵ���б���ʹ�õ��Լ��У�c1molL��1�ı�����Һ��c2molL��1�ı�Na2S2O3��Һ�������ᡢ������Һ������ˮ����֪��2Na2S2O3+I2�TNa2S4O6+2NaI)
(4)������ˮ�г��������۸�[Cr(��)]������Na2S2O5��FeSO47H2O�Ⱥ�������δ�����Cr2O72���ķ�ˮ��ʵ������ͼ��
��ʵ���������Һ��pH�������ߵ�ԭ���� ��
����֪��Ksp[Cr(OH)3]=6.4��10��31��lg2��0.3��c(Cr3+)��1.0��10��5molL��1ʱ��Ϊ��ȫ�������ֽ���ˮ��Cr2O72��ȫ��ת��ΪCr(OH)3����ȥ���������Һ��pH��ΧΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ʵ�飺�ٳ�ȥ����ֲ�����е�ˮ���ڻ��յ��CCl4��Һ�е�CCl4������ʳ�þƾ������в�ҩ��ȡ���е���Ч�ɷ֡�����ʵ����õ���ȷ����������( )
A����Һ����ȡ������
B����ȡ������Һ
C����Һ��������ȡ
D��������ȡ����Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������������õķ���ʴ�ԣ��ڹ�����ҵ�������������о��зdz���Ҫ�����á���ͼ�Ǵ����������Ʊ����Ĺ������̣�

��֪�����������Ҫ�ɷ���Al2O3�������������SiO2��Fe2O3��MgO���ʣ��ش��������⣺
I��(1)���������������˺���������A����Ҫ�ɷ�Ϊ____________��
(2)�ڹ��������У�������������������Һ���������ӷ�Ӧ����_________�������з��������ܽ�����ӷ�Ӧ����ʽΪ____________��
(3)��������Ķ�����̼ʱ�����ɳ��������ӷ���ʽΪ____________��
(4)�����������ÿ����1molA1ʱ������____g������
����������ֵ�����������
(1)����������Ʒ����Ϊm��������Aϴ�ӡ���������Ϊm1��������Bϴ�ӡ�������պ����Ϊm2���÷����ܲ�����������ijɷ�����Ӧ������������____________��
(2)ϴ������A���ϴ��Һ�Ƿ�����뵽��һ�ι��˺����Һ��_____�����ǡ������������A�Ƿ�ϴ�Ӹɾ��ķ�����____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����������ʳ��ҵ�����͵��ж��¼�������ԭ���ǹ�ҵƷ��װ�л����л������������й�������ȷ����(����)
A. ��������Ȼ�л��߷��ӻ�����
B. �����Ǹ�֬���������
C. ���ͷ���������Ӧ����ӦҺʹ��ɫʯ����ֽ���
D. ����������Ӧ��ȫ������ӦҺ���÷�Ϊ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������������
A. �ý����ƿ��������Ҵ�������
B. �ø������������Һ�����ּ����3-��ϩ
C. ��ˮ�����ֱ����屽
D. �����Ƶ�������Һ�����ּ����������ȩ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com