
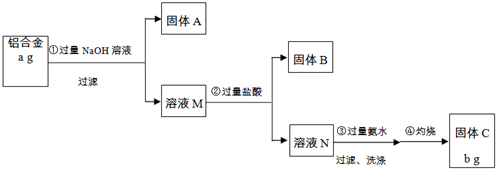
| ||
| ag |
| 9b |
| 17a |
| 9b |
| 17a |


 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:高中化学 来源: 题型:
| A、1L 1mol/L的FeCl3液中含Fe3+的数目为NA |
| B、室温下,21.0g乙烯和丁烯的混合气体中含有的子数目为1.5NA |
| C、标准状况下,2.24LCl2与足量稀NaOH溶液反应,转移的电子总数为0.2NA |
| D、18gNH4-中含有的质子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入KSCN溶液显血红色的溶液中:Fe2+、Mg2+、Cl-、SO42- |
| B、能与金属铝反应放出氢气的溶液中:K+、NO3-、Cl-、Fe2+ |
| C、常温下水电离出的c(H+)?c(OH-)=10-20 (mol?L-1)2的溶液中:Na+、ClO-、S2-、NH4+ |
| D、在AlCl3溶液中,Na+、AlO2-、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
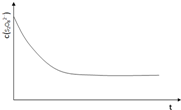 碘在科研与生活中有重要应用.某一兴趣小组用0.50mol?L-1 KI、0.2%淀粉溶液、0.20mol?L-1K2S2O8、0.10mol?L-1Na2S2O3等试剂,探究反应条件对化学反应速率的影响.
碘在科研与生活中有重要应用.某一兴趣小组用0.50mol?L-1 KI、0.2%淀粉溶液、0.20mol?L-1K2S2O8、0.10mol?L-1Na2S2O3等试剂,探究反应条件对化学反应速率的影响.| 实验序号 | 体积V/m | ||||
| 水 | Na | ||||
| ① | 0.0 | 0.0 | 4.0 | 4.0 | .0 |
| ② | 9.0 | .0 | 4.0 | 4.0 | .0 |
| ③ | .0 | Vx | 4.0 | 4.0 | .0 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
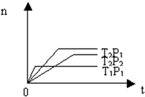 反应2X(g)+Y(g)?2Z(g);△H<0(正反应为放热反应),在不同温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量[n(Z)]与反应时间(t)的关系如图所示.则下列判断正确的是( )
反应2X(g)+Y(g)?2Z(g);△H<0(正反应为放热反应),在不同温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量[n(Z)]与反应时间(t)的关系如图所示.则下列判断正确的是( )| A、T1<T2,P1<P2 |
| B、T1<T2,P1>P2 |
| C、T1>T2,P1>P2 |
| D、T1>T2,P1<P2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 阳离子 | Na+,Al3+,Ag+,Ba2+,Fe3+ |
| 阴离子 | Cl-,CO32-,SO42-,NO3-,OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
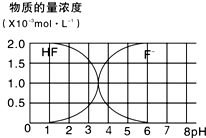 (1)含有弱酸HA和其钠盐NaA的混合溶液,在化学上用作缓冲溶液.向其中加入少量酸或碱时,溶液的酸碱性变化不大.现将0.04mol?L-1HA溶液和0.02mol?L-1NaOH溶液等体积混合,得到缓冲溶液.
(1)含有弱酸HA和其钠盐NaA的混合溶液,在化学上用作缓冲溶液.向其中加入少量酸或碱时,溶液的酸碱性变化不大.现将0.04mol?L-1HA溶液和0.02mol?L-1NaOH溶液等体积混合,得到缓冲溶液.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com