
【题目】在催化条件下发生反应:N2O(g)+CO(g) ![]() CO2(g)+N2(g)可使环境污染性气体转化为无害气体。反应进程中的能量变化如图所示。下列说法正确的是
CO2(g)+N2(g)可使环境污染性气体转化为无害气体。反应进程中的能量变化如图所示。下列说法正确的是

A. 加入催化剂使反应的△H变小
B. 该反应的热化学方程式为:N2O(g)+CO(g) ![]() CO2(g)+N2(g) △H﹦ - 226 kJ/mol
CO2(g)+N2(g) △H﹦ - 226 kJ/mol
C. 反应物的总能量小于生成物的总能量
D. 该反应正反应的活化能大于逆反应的活化能
 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案科目:高中化学 来源: 题型:
【题目】燃煤的烟气中含有 SO2,为了治理雾霾天气,工厂采用多种方法实现烟气脱硫。
Ⅰ.(1)“湿式吸收法”利用吸收剂与 SO2 发生反应从而脱硫。下列试剂中适合用作该法吸收剂的是_____(填字母序号)。
a. 石灰乳 b.CaCl2溶液
(2)某工厂利用含 SO2 的烟气处理含Cr2O72-的酸性废水,吸收塔中反应后的铬元素以Cr3+形式存在,具体流程如下:

①用 SO2 处理含铬废水时,利用了 SO2 的_____性。
②吸收塔中发生反应的离子方程式为_____。
Ⅱ.石灰-石膏法和烧碱法是常用的烟气脱硫法。石灰-石膏法的吸收反应为Ca(OH)2+SO2= CaSO3↓+H2O。吸收产物亚硫酸钙由管道输送至氧化塔氧化,反应为2CaSO3+O2+4H2O =2CaSO4·2H2O。其流程如图:

烧碱法的吸收反应为2NaOH+SO2=Na2SO3+H2O。该法的特点是氢氧化钠碱性强、吸收快、效率高。其流程如图:

已知:
试剂 | Ca(OH)2 | NaOH |
价格(元/kg) | 0.36 | 2.9 |
吸收 SO2 的成本(元/mol) | 0.027 | 0.232 |
(3)石灰-石膏法和烧碱法相比,石灰-石膏法的优点是_______,缺点是_______。
(4)某学习小组在石灰-石膏法和烧碱法的基础上,设计一个改进的、能实现物料循环的烟气脱硫方案,流程图中的甲、乙、丙各是_____、_____、_____(填化学式)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】萜类化合物广泛存在于动植物体内,关于下列萜类化合物的说法正确的是( )

A.b能在NaOH醇溶液条件下发生消去反应
B.与a互为同分异构体的二元取代的芳香化合物有9种
C.b分子中所有碳原子可能均处于同一平面上
D.a、c均能与溴水发生加成反应,且1mol 分子分别最多消耗3 mol、1 mol Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向100mL的FeBr2溶液中通入标准状况下的C12 3.36 L后,C12全部被还原,并且测得溶液中c(Br–)=c(Cl–),则原FeBr2溶液的物质的量浓度是
A.3mol/LB.2mol/ LC.1.5 mol/ LD.0.75mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种短周期元素,原子序数依次增大,A、E同主族,A元素的原子半径是所有原子中最小的,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物的水化物与其氢化物能发生化合反应生成一种盐,D元素是地壳中含量最高的元素。回答下列问题:
(1)C元素的名称是____,在周期表中的位置是________。
(2)化合物BD2的结构式是_________,化合物EA的电子式是___________。
(3)A、D、E三种元素形成的化合物中含有的化学键类型有_________。
(4) D、E元素分别形成的简单离子半径大小关系是_____(用离子符号表示);B、C元素分别形成的简单气态氢化物的稳定性大小关系是___________(用化学式表示)。
(5)C元素的简单气态氢化物遇到蘸有浓硝酸的玻璃棒的现象是_________,其原因是_________(用化学方程式解释)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三硫化四磷用于制造火柴即火柴盒摩擦面,分子结构如图所示。下列有关三硫化四磷的说法正确的是( )
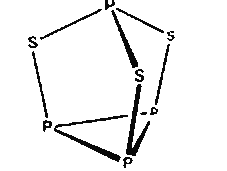
A. 该物质中磷元素的化合价为+3
B. 22 g P4S3含硫原子数目约为1.806×1023
C. 该物质分子结构中S、P最外层电子数均不为8
D. 该物质分子中全是极性共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PCl3和PCl5都是重要的化工原料。将PCl3(g)和Cl2(g)充入2L的恒容密闭容器中,在一定条件下发生反应PCl3(g)+Cl2(g)![]() PCl5(g),△H<0并于10 min时达到平衡。有关数据如下:
PCl5(g),△H<0并于10 min时达到平衡。有关数据如下:
PCl3(g) | Cl2(g) | PCl5(g) | |
初始浓度/(mol·L-1) | 2.0 | 1.0 | 0 |
平衡浓度/(mol·L-1) | c1 | c2 | 0.4 |
下列判断不正确的是
A. 10 min内,v(Cl2)=0.04 mol/( L·min)
B. 升高温度,反应的平衡常数增大
C. 反应达到平衡时容器内的压强与初始时容器的压强之比为13:15
D. 平衡后移走2.0 mol PCl3和1.0 mol Cl2,相同条件下再达平衡时,c(PCl5)<0.2 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
①金属氧化物一定是碱性氧化物 ②碱性氧化物一定是金属氧化物
③酸性氧化物一定是非金属氧化物 ④非金属氧化物不一定是酸性氧化物
⑤能电离出![]() 的化合物一定是酸 ⑥
的化合物一定是酸 ⑥![]() 属于一元酸
属于一元酸
⑦含有氧元素的化合物都是氧化物 ⑧酸性氧化物不一定能与水化合生成酸
A.2个B.3个C.4个D.5个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知水在25℃和95℃时,其电离平衡曲线如下图所示:

(1)25℃时水的电离平衡曲线应为______(选填“A”或“B”);
(2)25℃时,将pH=9的NaOH溶液与pH=4的盐酸溶液混合,若所得混合溶液的pH=7,则NaOH溶液与盐酸溶液的体积比为________;
(3)95℃时,若100体积pH=a的某强酸溶液与1体积pH=b的某强碱溶液混合后溶液呈中性,则混合前,a与b之间应满足的关系是__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com