
【题目】下列变化属于物理变化的是( )。
A. 煤的干馏 B. 裂解
C. 从煤焦油中得到苯、甲苯、二甲苯等 D. 古代植物转化成煤
科目:高中化学 来源: 题型:
【题目】我国“长征二号F”运载火箭发射现场.可以看到从火箭的下部喷射出大量的红棕色的气体,关于这种红棕色气体的认识正确的是
A.是溴蒸气,火箭发射时作氧化剂
B.是二氧化氮气体,火箭发射时作还原剂
C.是溴蒸气,火箭发射时作还原剂
D.是二氧化氮气体,火箭发射时作氧化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述中正确的是( )
A. 等物质的量的NaN3和Na2O2中所含阴离子数均为NA
B. 电解精炼铜时,若阳极质量减少6.4g,则电路中转移电子数为0.2NA
C. 标准状况下,将3.36LCl2通入1L0.2mol/LFeBr2溶液中,被氧化的Br-数目为0.1NA
D. 标准状况下,11g由3H和16O组成的超重水中,中子数和电子数之和为10NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将足量CO2通入KOH和Ca(OH)2的混合溶液中,生成沉淀的质量(m)和通入CO2体积(V)的关系如图所示: 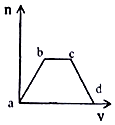
(1)ab段发生的离子反应方程式为 .
(2)bc段依次发生两个离子反应,首先是 , 其次是 .
(3)cd段发生的离子反应方程式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上通常采用CO(g)和H2(g)催化合成甲醇CH3OH(g).
(1)在—定温度和压强下,CO(g)+2H2(g)![]() CH3OH(g) ΔH=-128.8 kJ/mol.若将10a mol CO和20a mol H2放入2 L的密闭容器中,充分反应后测得CO的转化率为60%,则该反应的平衡常数为________(用含a的代数式表示).若此时再向该容器中投入10a mol CO、20a mol H2和10a mol CH3OH(g),判断平衡移动的方向是_______(填“正向移动”、“逆向移动”或“不移动”)。
CH3OH(g) ΔH=-128.8 kJ/mol.若将10a mol CO和20a mol H2放入2 L的密闭容器中,充分反应后测得CO的转化率为60%,则该反应的平衡常数为________(用含a的代数式表示).若此时再向该容器中投入10a mol CO、20a mol H2和10a mol CH3OH(g),判断平衡移动的方向是_______(填“正向移动”、“逆向移动”或“不移动”)。
(2)判断该反应达到平衡状态的依据是________(填字母序号).
A.混合气体的密度不变
B.混合气体的平均相对分子质量不变
C.2v逆(H2)=v正(CO)
D.容器内CO、H2、CH3OH的浓度之比为1∶2∶1
E.CH3OH、CO、H2的浓度都不再发生变化
(3)一定条件下,在容积相同的三个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
容器 | 甲 | 乙 | 丙 | |
反应物投入量 | 1 mol CO、2 mol H2 | 1 mol CH3OH | 2 mol CH3OH | |
平衡时数据 | 反应能量变化的绝对值(kJ) | a | b | c |
反应物转化率 | α1 | α2 | α3 | |
体系压强(Pa) | p1 | p2 | p3 | |
则a+b=________;a1+a3________1(填“<”、“>”或“=”,下同);2p2________p3.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列递变情况中,正确的是
A. Na、Mg、Al原子的最外层电子数依次减少
B. Si、P、S元素的最高正价依次降低
C. C、N、O的原子半径依次减小
D. Li、Na、K的金属性依次减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用KMnO4氧化密度为1.19gcm﹣3 , 溶质质量分数为36.5%的HCl溶液.反应方程式如下:
KMnO4+HCl═ KCl+MnCl2+Cl2↑+H2O
(1)请配平方程,并用双线桥法表示该反应电子转移情况
(2)盐酸的物质的量浓度
(3)15.8gKMnO4能氧化 mol的HCl,转移电子数约为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com