
【题目】下列反应的离子方程式书写正确的是( )
A. 氢氧化钡溶液和稀硫酸反应:Ba2+ + SO42-=BaSO4↓
B. 铁与稀硫酸反应: 2Fe + 6H+ =2Fe3+ + 3H2↑
C. 氯气与水反应:Cl2 + H2O =2H+ +C1- + ClO-
D. 氯化铝溶液中加入过量氨水:Al3+ + 3NH3·H2O=Al(OH)3↓+ 3 NH4+
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 由反应SiO2+2C ![]() Si+2CO↑,可得出C的非金属性强于Si
Si+2CO↑,可得出C的非金属性强于Si
B. 由分子组成的物质中一定存在共价键
C. 对于平衡2HI(g)![]() I2(g)+H2(g),压缩容器体积,平衡不移动,气体的颜色不变
I2(g)+H2(g),压缩容器体积,平衡不移动,气体的颜色不变
D. 水的电离是吸热过程,升高温度,水的离子积增大、pH减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将一定量的钠铝合金置于水中,合金全部溶解,得到20 mL pH=14的溶液,然后用1 mol/L的盐酸滴定,测得生成沉淀的质量与消耗盐酸的体积关系如图所示,则下列说法正确的是( )

A. 原合金质量为 0.92 g
B. 产生氧气的体积为896 mL(标准状况下)
C. 图中m的值为1.56
D. 图中V2的值为60
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量混合气体在密闭容器中发生反应:xA(g)+yB(g)![]() zC(g)+Q,平衡后测得A气体浓度为0.5mol·L-1;当恒温下将密闭容器的容积变为原来的两倍后再次达到平衡时,测得A的浓度为0.3mol·L-1。则下列叙述正确的是
zC(g)+Q,平衡后测得A气体浓度为0.5mol·L-1;当恒温下将密闭容器的容积变为原来的两倍后再次达到平衡时,测得A的浓度为0.3mol·L-1。则下列叙述正确的是
A.平衡向右移动 B.x+y>z
C.B的转化率提高 D.C的体积分数增加
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列各图的叙述错误的是 ( )


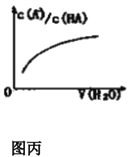
A. 已知1molCO燃烧放出的热为283kJ,2H2(g)+O2(g)=2H2O(g);ΔH= - 483.6kJ/mol则图甲表示CO和H2O(g)生成CO2和H2的能量变化
B. 常温下0.2 mol·L-1 HA溶液和0.1mol·L-1NaOH溶液等体积混合后溶液的pH=3,则混合溶液中离子浓度的大小顺序为:c(A-)> c(Na+)>c(H+)>c(OH-)
C. 常温下,X2(g)和H2反应生成HX的平衡常数如表乙所示,仅依据K的变化,就可以说明在相同条件下,平衡时X2(从F2到I2)的转化率逐渐减小,且HX的还原性逐渐减弱
D. 图丙中曲线表示常温下向弱酸HA的稀溶液中加水稀释过程中,![]() 的变化情况
的变化情况
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高分子材料PET聚酯树脂和PMMA的合成路线如下:

已知:
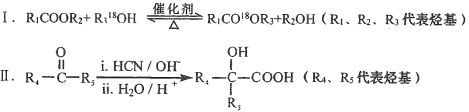
(1)①的反应类型是_______________。
(2)②的化学方程式为_______________。
(3)PMMA单体的官能团名称是________________________________________________。
(4)F的核磁共振氢谱显示只有一组峰,⑤的化学方程式为_________________。
(5)G的结构简式为_________________________。
(6)下列说法正确的是_____________(填字母序号)。
a.⑦为酯化反应
b.B和D互为同系物
c.1 mol  与足量NaOH溶液反应时,最多消耗4 mol NaOH
与足量NaOH溶液反应时,最多消耗4 mol NaOH
(7)J的某种同分异构体与J具有相同官能团,且为顺式结构,其结构简式是_______。
(8)写出由PET单体制备PET聚酯并生成B的化学方程式_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校研究性学习小组用已部分生锈(Fe2O3)的废铁屑,制作印刷电路板的腐蚀剂,即FeCl3溶液。实验操作过程如下:
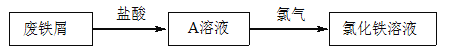
根据要求回答问题:
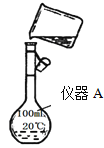
(1)用浓盐酸配制250mL 0.2molL-1稀盐酸,图中有两处错误分别是_____________,______________。
(2)废铁屑用盐酸处理后,还含有不溶性杂质,为获取澄清的A溶液,进行物质分离的操作名称是___________。
(3)若FeCl2溶液中混有少量的FeCl3溶液,现要加入一种试剂除去FeCl3,请写出除杂的离子方程式______________________。
(4)配制250mL 0.2molL-1稀盐酸时,下列操作会造成结果偏高的是(_______)
A.配制溶液时,若加水超过容量瓶刻度,应用胶头滴管将多余溶液吸出
B.转移溶液前溶液未冷却至室温
C.未洗涤烧杯和玻璃棒
D.定容时俯视容量瓶的刻度线
E.容量瓶洗涤干净后,瓶内壁有少量水滴。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验原理或操作正确的是 ( )
A. 用20 mL量筒量取15 mL酒精,加水5 mL,配制质量分数为75%酒精溶液
B. 在200 mL某硫酸盐溶液中,含有1.5NA个硫酸根离子,同时含有NA个金属离子,则该硫酸盐的物质的量浓度为2.5 mol·L-1
C. 实验中需用2.0 mol·L-1的Na2CO3溶液950 mL,配制时应选用的容量瓶的规格和称取Na2CO3的质量分别为950 mL、201.4 g
D. 实验室配制500 mL 0.2 mol·L-1的硫酸亚铁溶液,其操作是:用天平称15.2 g绿矾(FeSO4·7H2O),放入小烧杯中加水溶解,转移到500 mL容量瓶,洗涤、稀释、定容、摇匀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验的反应原理用离子方程式表示正确的是( )
A. 室温下,测的氯化铵溶液pH<7,证明一水合氨的是弱碱:NH4++2H2O=NH3·H2O+H3O+
B. 用氢氧化钠溶液除去镁粉中的杂质铝:2Al+2OH-+2H2O=2AlO2-+3H2↑
C. 用碳酸氢钠溶液检验水杨酸中的羧基:
 +2HCO3-→
+2HCO3-→ +2H2O+2CO2↑
+2H2O+2CO2↑
D. 用高锰酸钾标准溶液滴定草酸:2MnO4-+16H++5C2O42-=2Mn2++10CO2↑+8H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com