
【题目】药物异搏定合成路线中,其中的一步转化如下:
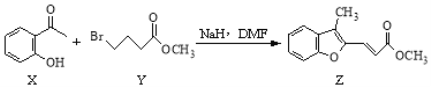
下列说法正确的是
A. Y的分子式为C5H9O2Br
B. X分子中所有原子在同一平面内
C. Z和足量H2加成后的分子中有5个手性碳原子
D. 等物质的量的X、Z分别与溴水反应,最多消耗Br2的物质的量之比1:1
【答案】AD
【解析】分析:根据有机物的结构可知,Y的分子式为C 5H 9O 2Br ,利用X含苯环、碳氧双键为平面结构,Z分子含碳碳双键、苯环、酯基等来分析解答。
详解:A.由Y结构可知,分子式为C 5H 9O 2Br,故A正确;
B.苯环、碳氧双键为平面结构,与苯环、双键之间相连的原子在同一平面内,而甲基上的氢原子不可能在同一平面内,故B错误;
C.Z和足量H2加成后的分子为 ,共有如图标记出的4个手性碳原子,故C错误;
,共有如图标记出的4个手性碳原子,故C错误;
D.X具有酚羟基,1molX和溴水发生取代反应,消耗2molBr2,Z分子中含有两个碳碳双键,1molZ和2molBr2发生加成法应,所以等物质的量的X、Z分别与溴水反应,最多消耗Br2的物质的量之比1:1,故D正确; 本题选AD。


 新思维寒假作业系列答案
新思维寒假作业系列答案科目:高中化学 来源: 题型:
【题目】下列关于硅酸盐工业的叙述正确的是
A. 普通玻璃的主要成分可以表示为Na2O·CaO·6SiO2,说明玻璃为纯净物
B. 陶瓷、玻璃、水泥都属于硅酸盐产品
C. 制玻璃、水泥时都用到了石灰石和黏土
D. 制玻璃的过程中发生了反应:Na2CO3+SiO2![]() Na2SiO3+CO2↑,说明酸性:H2SiO3>H2CO3
Na2SiO3+CO2↑,说明酸性:H2SiO3>H2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】测定0.1 mol·L-1 Na2SO3溶液先升温再降温过程中的pH,数据如下。
时刻 | ① | ② | ③ | ④ |
温度/℃ | 25 | 30 | 40 | 25 |
pH | 9.66 | 9.52 | 9.37 | 9.25 |
实验过程中,取①④时刻的溶液,加入盐酸酸化的BaCl2溶液做对比实验,④产生白色沉淀多。
下列说法不正确的是
A. Na2SO3溶液中存在水解平衡:![]() +H2O
+H2O![]()
![]() +OH
+OH
B. ④的pH与①不同,是由于![]() 浓度减小造成的
浓度减小造成的
C. ①→③的过程中,温度和浓度对水解平衡移动方向的影响一致
D. ①与④的Kw值相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷精矿湿法制备磷酸的一种工艺流程如下:

已知:磷精矿主要成分为Ca5(PO4)3(OH),还含有Ca5(PO4)3F和有机碳等。
溶解度:Ca5(PO4)3(OH)<CaSO4·0.5H2O
(1)上述流程中能加快反应速率的措施有__________。
(2)磷精矿粉酸浸时发生反应:
2Ca5(PO4)3(OH)+3H2O+10H2SO4![]() 10CaSO4·0.5H2O+6H3PO4
10CaSO4·0.5H2O+6H3PO4
①该反应体现出酸性关系:H3PO4__________H2SO4(填“>”或“<”)。
②结合元素周期律解释①中结论:P和S电子层数相同,__________。
(3)酸浸时,磷精矿中Ca5(PO4)3F所含氟转化为HF,并进一步转化为SiF4除去。写出生成HF的化学方程式:__________。
(4)H2O2将粗磷酸中的有机碳氧化为CO2脱除,同时自身也会发生分解。相同投料比、相同反应时间,不同温度下的有机碳脱除率如图所示。80℃后脱除率变化的原因:____________________。

(5)脱硫时,CaCO3稍过量,充分反应后仍有SO42残留,原因是__________;加入BaCO3可进一步提高硫的脱除率,其离子方程式是____________________。
(6)取a g所得精制磷酸,加适量水稀释,以百里香酚酞作指示剂,用b mol·L1NaOH溶液滴定至终点时生成Na2HPO4,消耗NaOH溶液c mL,精制磷酸中H3PO4的质量分数是________。(已知:H3PO4摩尔质量为98 g·mol1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是
A. c(Fe2+) =1 mol·L1的溶液中:K+、Fe3+、ClO-、SO42-
B. 0.1 mol·L1NH4Cl溶液中:Ba2+、OH-、AlO2-、NO3-
C. ![]() =1×10 12的溶液中:Na +、SO42-、Al3+、NO3-
=1×10 12的溶液中:Na +、SO42-、Al3+、NO3-
D. 由水电离的c(H+)=1×10 13mol·L1溶液中:Na+、K+、SO42-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)烷烃A在同温、同压下蒸气的密度是H:的43倍,其分子式为____分子中含102个氢原子的烷烃的分子式是_____
(2)用式量为43的烷基取代甲苯苯环上的一个氢原子,所得芳香烃产物的数目为__种。
(3)有机物 的正确命名为___________
的正确命名为___________
(4)立方烷 它的六氯代物有____种。
它的六氯代物有____种。
(5)  分子中最多有个____原子共面.
分子中最多有个____原子共面.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】超细铜粉有重要用途,工业上可以通过铝黄铜合金(含Cu、Al、Zn)制超细铜粉。某小组在实验室模拟制备超细铜粉的方法如下:
步骤Ⅰ:取铝黄铜合金加入热浓硫酸溶解,再加入过量NaOH溶液只生成Cu(OH)2沉淀,过滤,洗涤。
步骤Ⅱ:向Cu(OH)2沉淀中加硫酸溶解,再加氨水,形成 [Cu(NH3)4]SO4溶液。
步骤Ⅲ:向[Cu(NH3)4]SO4溶液中通入SO2气体至溶液呈微酸性,生成NH4CuSO3。再与足量的1.000mol·L-1的稀硫酸混合并微热,得到超细铜粉。
(1)步骤Ⅰ中完全溶解铝黄铜合金可以加入稀硫酸和____。
A.FeCl3 B.盐酸 C.热空气
(2)配制500 mL 1.000 mol·L-1的稀硫酸,需要用98%的浓硫酸(密度为1.84 g·mL-1)____mL。
(3)在步骤Ⅲ中生成NH4CuSO3的化学反应方程式为____。
(4)准确称取1.000 g铝黄铜合金与足量的1.000 mol·L-1稀硫酸完全反应,生成标准状况下气体体积为134.4 mL。将相同质量的合金完全溶于热的足量的浓硫酸,产生标准状况下气体体积为380.8mL。计算此合金中铜的质量分数________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】与氢气完全加成后,可能生成2,2,3-三甲基戊烷的烃是( )
A. CH2 ==CHCH==C(CH3)2 B. CH2==CHC(CH3)2CH(CH3)2
C. (CH3)3C-CH=CH2 D. (CH3)3CC(CH3)==CHCH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】假设图中原电池产生的电压、电流强度均能满足电解、电镀要求,即为理想化。①~⑧为各装置中的电极编号。当K闭合后,下列说法正确的有( )

①D装置中纯Cu电极反应为:Cu2++2e-=Cu
②整个电路中电子的流动方向为:③→②;①→⑧;⑦→⑥;⑤→④;
③C装置原理上是一个电镀池(Ag表面镀Cu),期中Cu作阴极,Ag作阳极
④A装置中C电极反应为:O2+4e-+2H2O=4OH-
A. ③④ B. ①② C. ②③④ D. ①②④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com