
【题目】在一定条件下,X气体与Y气体反应生成Z气体。反应过程中,反应物与生成物的物质的量浓度随时间变化的曲线如图所示,则下列叙述正确的是( )
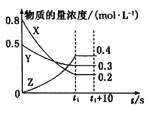
A.该反应的化学方程式为3X+Y=2Z
B.t1-(t1+10)s时,瞬时速度v(X)=v(Y)=0
C.0-t1s时反应物X的转化率为60%
D.0ls内X的反应速率为v(X)=![]() mol·L-1·s-1
mol·L-1·s-1
科目:高中化学 来源: 题型:
【题目】聚苯胺是一种在充放电过程中具有更优异可逆性的电极材料。Zn一聚苯胺二次电池的结构示意图如图所示,设NA为阿伏加德罗常数的值。下列说法错误的是( )
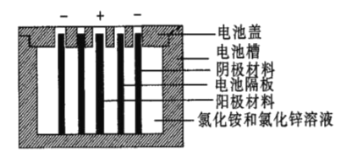
A.放电时,外电路每通过0.1NA个电子时,锌片的质量减少3.25g
B.充电时,聚苯胺电极的电势低于锌片的电势
C.放电时,混合液中的Cl-向负极移动
D.充电时,聚苯胺电极接电源的正极,发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置,在仪器①②③中分别依次加入下列各选项中所对应的试剂进行实验,能达到实验目的的是

A. 浓盐酸、浓硫酸、浓硫酸,制取干燥的氯化氢气体
B. 浓盐酸、二氧化锰、饱和食盐水,制取纯浄的氯气
C. 稀硫酸、溶液X、澄清石灰水,检验溶液X中是否含有CO32—
D. 浓盐酸、碳酸钙、水玻璃,验证盐酸、碳酸、硅酸的酸性强弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列图示所得结论正确的是
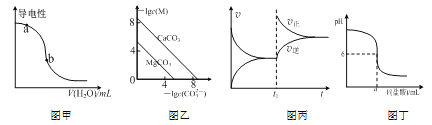
A.图甲表示一定温度下,CH3COOH稀溶液加水时溶液的导电性变化,则pH(a)>pH(b)
B.图乙表示一定温度下,MCO3(M:Mg2+、Ca2+)的沉淀溶解平衡曲线,则Ksp(MgCO3)<Ksp(CaCO3)
C.图丙表示一定温度下,可逆反应N2(g)+3H2(g) ![]() 2NH3(g)正逆反应速率随时间变化的曲线,t1时改变的条件可能是分离出NH3
2NH3(g)正逆反应速率随时间变化的曲线,t1时改变的条件可能是分离出NH3
D.图丁表示常温下将0.1 mol·L-1盐酸溶液滴加到a mL0.1 mol·L-1BOH溶液中,所得溶液pH随所加入盐酸溶液体积的变化图,则BOH为弱碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用方铅矿精矿(主要为![]() )和软锰矿(主要为
)和软锰矿(主要为![]() ,还有少量
,还有少量![]() 、
、![]() 等杂质)制备
等杂质)制备![]() 和
和![]() 的工艺流程如图:
的工艺流程如图:
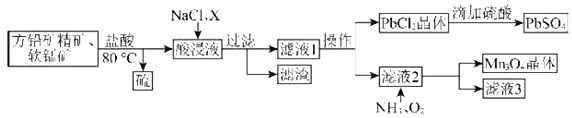
已知:①![]() 。
。
②![]() 。
。
(1)80℃用盐酸处理两种矿石,为加快酸浸速率,还可采用的方法是____________(任写一种)。
(2)向酸浸液中加入饱和食盐水的目的是_____________;加入物质X可用于调节酸浸液的![]() 值,物质X可以是___________(填字母)。
值,物质X可以是___________(填字母)。
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
(3)滤渣中含有两种金属杂质形成的化合物,其成分为___________(写化学式)。
(4)向滤液2中通入![]() 和
和![]() 发生反应,写出总反应的离子方程式:________________。
发生反应,写出总反应的离子方程式:________________。
(5)用![]() 为原料可以获得金属锰,合适的冶炼方法为____________(填字母)。
为原料可以获得金属锰,合适的冶炼方法为____________(填字母)。
A.热还原法 B.电解法 C.热分解法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知草酸是二元弱酸,0.2 mol·L-1NaHC2O4溶液显酸性,关于NaHC2O4溶液中离子浓度关系的叙述不正确的是( )
A.c(Na+)>c(HC2O4—)>c(C2O42—)>c(H2C2O4)
B.c(Na+)=c(HC2O4—)+c(C2O42—)+c(H2C2O4)
C.c(Na+)+c(H+)=c(HC2O4—)+c(C2O42—)+c(OH-)
D.c(H+)+c(H2C2O4)=c(C2O42—)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚砜(SOCl2)是一种液态化合物,沸点为77℃,在农药、制药行业中用途广泛。SOCl2遇水剧烈反应,液面上产生白雾,并带有刺激性气味的气体产生。实验室合成原理:SO2+Cl2+SCl2=2SOCl2,部分装置如图所示,(已知SCl2的沸点为50℃),回答以下问题:
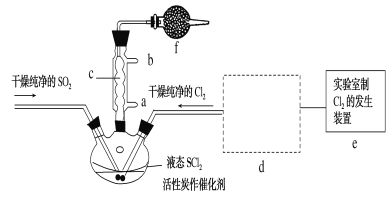
(1)下列四种制备SO2的方案中最佳选择是__。
方案 | A | B | C | D |
发生装置 |
|
|
|
|
所选试剂 | 70%H2SO4+K2SO3 | 18.4mol/LH2SO4+Cu | 4mol/LHNO3+Na2SO3 | NaHSO3固体 |
(2)以MnO2和浓盐酸为原料制备Cl2的离子方程式为__。
(3)仪器f的作用是__。
(4)d的虚线框内隐含两个装置,按气流方向顺序这两个装置的药品分别是__。
(5)实验结束后,将三颈烧瓶混合物中产品分离出来的方法是__。
(6)若用SOCl2作FeCl3·6H2O的脱水剂,设计实验证明脱水时发生了氧化还原反应。取少量FeCl3·6H2O于试管中,加入过量SOCl2,振荡,往试管中加水溶解,滴加__或__溶液,证明脱水过程发生了氧化还原反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,水的电离达到平衡:H2O![]() H++OH-;△H>0,下列叙述正确的是
H++OH-;△H>0,下列叙述正确的是
A.向水中加入少量固体NaHSO4,c(H+)增大,KW不变
B.向水中加入少量NaOH溶液,平衡逆向移动,c(OH-)降低
C.向水中加入少量CH3COONa固体,平衡逆向移动,c(H+)降低
D.将水加热,KW增大,pH不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酸性锌锰干电池是一种一次电池,外壳为金属锌,中间是碳棒,其周围是由碳粉、MnO2、ZnCl2和NH4Cl等组成的糊状填充物。该电池放电过程产生MnOOH。回收处理该废电池可得到多种化工原料。有关数据如表所示:
化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
Ksp近似值 | 10-17 | 10-17 | 10-39 |
用废电池的锌皮制备ZnSO4·7H2O的过程中,需除去锌皮中的少量杂质铁,其方法是加稀H2SO4和H2O2溶解,铁变为________,加碱调节pH为________时,铁刚好沉淀完全(离子浓度小于1×10-5 mol·L-1时,即可认为该离子沉淀完全);继续加碱至pH为________时,锌开始沉淀(假定Zn2+浓度为0.1 mol·L-1)。若上述过程不加H2O2后果是______________,原因是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com