
【题目】用方铅矿精矿(主要为![]() )和软锰矿(主要为
)和软锰矿(主要为![]() ,还有少量
,还有少量![]() 、
、![]() 等杂质)制备
等杂质)制备![]() 和
和![]() 的工艺流程如图:
的工艺流程如图:
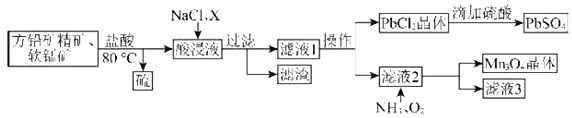
已知:①![]() 。
。
②![]() 。
。
(1)80℃用盐酸处理两种矿石,为加快酸浸速率,还可采用的方法是____________(任写一种)。
(2)向酸浸液中加入饱和食盐水的目的是_____________;加入物质X可用于调节酸浸液的![]() 值,物质X可以是___________(填字母)。
值,物质X可以是___________(填字母)。
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
(3)滤渣中含有两种金属杂质形成的化合物,其成分为___________(写化学式)。
(4)向滤液2中通入![]() 和
和![]() 发生反应,写出总反应的离子方程式:________________。
发生反应,写出总反应的离子方程式:________________。
(5)用![]() 为原料可以获得金属锰,合适的冶炼方法为____________(填字母)。
为原料可以获得金属锰,合适的冶炼方法为____________(填字母)。
A.热还原法 B.电解法 C.热分解法
【答案】粉碎矿石或搅拌或适当增加盐酸浓度 增大![]() 的溶解度 AD
的溶解度 AD ![]() 、
、![]() 6Mn2++12NH3+6H2O+O2=2Mn3O4+12NH4+ A
6Mn2++12NH3+6H2O+O2=2Mn3O4+12NH4+ A
【解析】
方铅矿精矿(主要成分PbS )和软锰矿(主要成分MnO2,含有Fe2O3、Al2O3等杂质)中加入稀盐酸并加热.至80°C,发生的反应有![]() Fe2O3 + 6HCl = 2FeCl3 +3H2O、 Al2O3 + 6HCl = 2AlCl3 + 3H2O,向酸浸溶液中加入NaCl溶液,调节溶液的pH,使铁离子和铝离子转化为沉淀,要除去这两种离子需要加入碱性物质且不能引进新的杂质,然后过滤得到氢氧化铁、氢氧化铝沉淀和滤液,将溶液蒸发浓缩、冷却结晶、过滤得到PbCl2晶体和滤液,向滤液中通入氨气、氧气,锰离子被氧化生成Mn3O4,将溶液过滤得到Mn3O4和滤液;金属的冶炼常根据金属的活泼性选择相应的方法,其中最活泼的金属用电解法,较活泼的金属用热还原法,不活泼金属用热分解法。
Fe2O3 + 6HCl = 2FeCl3 +3H2O、 Al2O3 + 6HCl = 2AlCl3 + 3H2O,向酸浸溶液中加入NaCl溶液,调节溶液的pH,使铁离子和铝离子转化为沉淀,要除去这两种离子需要加入碱性物质且不能引进新的杂质,然后过滤得到氢氧化铁、氢氧化铝沉淀和滤液,将溶液蒸发浓缩、冷却结晶、过滤得到PbCl2晶体和滤液,向滤液中通入氨气、氧气,锰离子被氧化生成Mn3O4,将溶液过滤得到Mn3O4和滤液;金属的冶炼常根据金属的活泼性选择相应的方法,其中最活泼的金属用电解法,较活泼的金属用热还原法,不活泼金属用热分解法。
(1)采取粉碎矿石或搅拌或适当增加盐酸浓度等措施均能加快酸浸速率,故答案为:粉碎矿石或搅拌或适当增加盐酸浓度;
(2)由可逆反应![]() ,可知向酸浸液中加入饱和食盐水,通过增大C1-浓度可促进PbCl2的溶解;加入试剂调节溶液的pH,使铁离子和铝离子转化为沉淀,同时不引入新的杂质,结合滤液1中含有Mn2+和Pb2+可选择MnCO3和PbO调节溶液pH, 即AD正确,故答案为:增大PbCl2的溶解度;AD;
,可知向酸浸液中加入饱和食盐水,通过增大C1-浓度可促进PbCl2的溶解;加入试剂调节溶液的pH,使铁离子和铝离子转化为沉淀,同时不引入新的杂质,结合滤液1中含有Mn2+和Pb2+可选择MnCO3和PbO调节溶液pH, 即AD正确,故答案为:增大PbCl2的溶解度;AD;
(3)酸浸液中加入MnCO3或PbO调节溶液pH, 促进溶液中Fe3+和A13+完全转化为Al(OH)3和Fe(OH)3沉淀,其中Al(OH)3是两性氢氧化物,能溶于NaOH溶液,而Fe(OH)3不能,可利用过滤操作进行分离出Fe(OH)3,故答案为:Al(OH)3 ;Fe(OH)3;
(4)滤液2中含有Mn2+ 通入NH3和O2生成Mn3O4 , 发生反应的离子方程式为6Mn2+ + 12NH3 + 6H2O + O2=2Mn3O4+12NH4+,故答案为: 6Mn2+ + 12NH3 + 6H2O + O2=2Mn3O4+12NH4+;
(5) Mn金属是较活泼的金属,用Mn3O4为原料通过热还原法获得金属锰,即选项A正确,故答案为: A 。


科目:高中化学 来源: 题型:
【题目】常温下,向20mL 0.1mol·L-1氨水中滴加某浓度的硫酸溶液,溶液中水电离的c(H+)随加入硫酸的体积变化如图所示。下列说法不正确的是

A.若a点对应水电离的c(H+)=1.0×10-11mol·L-1,则此时氨水的电离程度为1%
B.c点时氨水与硫酸恰好完全反应
C.c点对应溶液中:c(H+)-c(OH-)=c(NH3·H2O)
D.若b、d点对应水电离的c(H+)=1.0×10-7mol·L-1,则两溶液中均存在:c(NH4+)=2c(SO42-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无色气体N2O4是一种强氧化剂,为重要的火箭推进剂之一。N2O4与NO2转换的热化学方程式为N2O4(g)![]() 2NO2(g) ΔH=+24.4 kJ/ mol。
2NO2(g) ΔH=+24.4 kJ/ mol。
(1)将一定量N2O4投入固定容积的真空容器中,下述现象能说明反应达到平衡的是____
a v正(N2O4)=2v逆(NO2) b 体系颜色不变
c 气体平均相对分子质量不变 d 气体密度不变
(2)平衡常数K可用反应体系中气体物质分压表示,即K表达式中用平衡分压代替平衡浓度,分压=总压×物质的量分数[例如:p(NO2)=p总×x(NO2)]。写出上述反应平衡常数Kp表达式_________(用p总、各气体物质的量分数用x表示);
(3)上述反应中,正反应速率v正=k正·p(N2O4),逆反应速率v逆=k逆·p2(NO2),其中k正、k逆为速率常数,则Kp为_______(以k正、k逆表示)。若将一定量N2O4投入真空容器中恒温恒压分解(温度298K、压强100kPa),已知该条件下k正=4.8×104s-1,当N2O4分解10%时,v正=_______kPa·s-1。(结果保留两位有效数字)
(4)真空密闭容器中放入一定量N2O4,维持总压强p0恒定,在温度为T时,平衡时N2O4分解百分率为α。保持温度不变,向密闭容器中充入等量N2O4,维持总压强在2p0条件下分解,则N2O4的平衡分解率的表达式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期主族元素![]() 和W的原子序数依次增大,X和Y的单质化合生成气体A,A分子中的电子数与氖原子相同,X和W的单质化合生成气体B,常温下
和W的原子序数依次增大,X和Y的单质化合生成气体A,A分子中的电子数与氖原子相同,X和W的单质化合生成气体B,常温下![]() 的B溶液的
的B溶液的![]() ,气体A和气体B相遇产生白烟,X与Z可按原子个数比1∶1形成化合物C。下列说法正确的是( )
,气体A和气体B相遇产生白烟,X与Z可按原子个数比1∶1形成化合物C。下列说法正确的是( )
A.化合物C可能为离子化合物
B.Z离子的半径比Y离子的大
C.Y的非金属性很强,其单质非常活泼
D.氧化物的水化物的酸性:Y比W强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学工作者研发了一种![]() 的系统,借助锂循环可持续合成氨,其原理如图所示:
的系统,借助锂循环可持续合成氨,其原理如图所示:
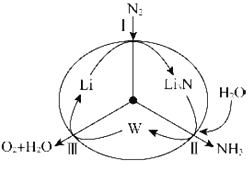
(1)过程Ⅰ得到Li3N的电子式为___________。
(2)过程Ⅱ生成W的化学反应方程式为____________。
(3)实验室制取氨气的化学反应方程式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,X气体与Y气体反应生成Z气体。反应过程中,反应物与生成物的物质的量浓度随时间变化的曲线如图所示,则下列叙述正确的是( )
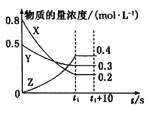
A.该反应的化学方程式为3X+Y=2Z
B.t1-(t1+10)s时,瞬时速度v(X)=v(Y)=0
C.0-t1s时反应物X的转化率为60%
D.0ls内X的反应速率为v(X)=![]() mol·L-1·s-1
mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用含有铁锈(Fe2O3)的废铁屑来制取氯化铁晶体的装置(省略夹持装置,气密性已检查)如图所示。下列推断不合理的是( )
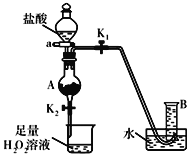
A.烧杯中H2O2溶液作用是将Fe2+氧化为Fe3+
B.A中存在氧化铁与盐酸反应生成氯化铁的反应
C.B中收集到的气体是氢气
D.反应后的烧杯中通入少量SO2,则溶液颜色立即由棕黄色变为浅绿色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实一定能说明HF是弱酸的是( )
①常温下NaF溶液的pH大于7; ②用HF溶液做导电性实验,灯泡很暗;
③HF与NaCl不能发生反应; ④常温下0.1mol/L的HF溶液的pH为2.3
⑤HF能与Na2CO3溶液反应,产生CO2气体 ⑥HF与水能以任意比混溶
⑦1mol/L的HF水溶液能使紫色石蕊试液变红
A. ①④ B. ②③⑤ C. ③④⑥ D. ①②⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以TiO2为催化剂的光热化学循环分解CO2反应为温室气体减排提供了一个新途径,该反应的机理及各分子化学键完全断裂时的能量变化如下图所示。
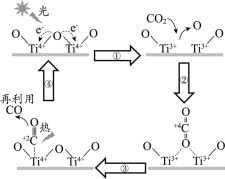
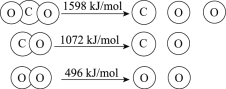
下列说法正确的是
A.过程①中钛氧键断裂会释放能量
B.该反应中,光能和热能转化为化学能
C.使用TiO2作催化剂可以降低反应的焓变,从而提高化学反应速率
D.CO2分解反应的热化学方程式为2CO2(g) =2CO(g) + O2(g) ΔH= + 30 kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com