
【题目】在有机合成中,常需要将官能团消除或增加 ,按要求完成下列各题。
乙烯→乙二醇:CH2=CH2 ![]() CH2Br—CH2Br
CH2Br—CH2Br ![]() HOCH2CH2OH
HOCH2CH2OH
溴乙烷→乙醇:CH3CH2Br ![]() CH2=CH2
CH2=CH2![]() CH3CH2OH
CH3CH2OH
(1)①的化学方程式_______________________________________ 反应类型________________
(2)②的化学方程式__________________________________________反应类型_______________
(3)③的化学方程式_______________________________________反应类型_______________
(4)④的化学方程式_______________________________________反应类型__________________
【答案】H2C=CH2+Br2→CH2BrCH2Br 加成反应 CH2Br-CH2Br+2NaOH →CH2OH-CH2OH +2NaBr 取代反应或水解反应 CH3CH2Br+NaOH→ CH2=CH2↑+NaBr+H2O 消去反应 CH2=CH2 + H2O→CH3CH2OH (乙醇) 加成反应
【解析】
CH2=CH2 和溴发生加成反应生成CH2Br—CH2Br,CH2Br—CH2Br在氢氧化钠的水溶液中发生水解反应生成CH2OH-CH2OH;CH3CH2Br 在氢氧化钠的醇溶液中发生消去反应生成CH2=CH2,CH2=CH2和水发生加成反应生成 CH3CH2OH;
(1)①是乙烯和溴发生加成反应生成1,2-二溴乙烷,反应的化学方程式是H2C=CH2+Br2→CH2BrCH2Br, 反应类型加成反应;
(2)②是CH2Br—CH2Br在氢氧化钠的水溶液中发生水解反应生成乙二醇、溴化钠,反应的化学方程式CH2Br-CH2Br+2NaOH →CH2OH-CH2OH +2NaBr,反应类型为取代反应或水解反应;
(3)③是CH3CH2Br在氢氧化钠的醇溶液中发生消去反应生成 CH2=CH2和溴化钠、水,化学的化学方程式是CH3CH2Br+NaOH→ CH2=CH2↑+NaBr+H2O,反应类型为消去反应;
(4)④是CH2=CH2和水发生加成反应生成CH3CH2OH,反应的化学方程式为CH2=CH2 + H2O→CH3CH2OH,反应类型是加成反应;


科目:高中化学 来源: 题型:
【题目】吊白块( NaHSO2·HCHO·2H2O,M=154.0g/mol)在工业中有广泛应用;吊白块在酸性环境下、100℃即发生分解释放出HCHO。实验室制备吊白块的方案如下:
NaHSO3的制备:
如图,在广口瓶中加入一定量Na2SO3和水,振荡溶解,缓慢通入SO2,至广口瓶中溶液pH约为4,制得NaHSO3溶液。
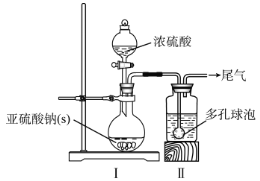
(1)装置Ⅰ中产生气体的化学反应方程式为__;Ⅱ中多孔球泡的作用是__。
(2)实验室检测NaHSO3晶体在空气中是否发生氧化变质的实验方案是__。
吊白块的制备:
如图,向仪器A中加入上述NaHSO3溶液、稍过量的锌粉和一定量甲醛,在80~90℃C下,反应约3h,冷却过滤。

(3)仪器A的名称为___;用恒压漏斗代替普通滴液漏斗滴加甲醛的优点是__。
(4)将仪器A中的反应温度恒定在80~90℃的目的是__。
吊白块纯度的测定:
将0.5000g吊白块样品置于蒸馏烧瓶中,加入10%磷酸10mL,立即通入100℃水蒸气;吊白块分解并释放出甲醛,用含36.00mL0.1000mol·L-1酸性KMnO4吸收甲醛(不考虑SO2影响,4MnO4-+5HCHO+12H+=4Mn2++5CO2↑+11H2O),再用0.1000mol·L-1的草酸标准溶液滴定酸性KMnO4,再重复实验2次,平均消耗草酸溶液的体积为30.00mL。
(5)滴定终点的判断方法是__;吊白块样品的纯度为__%(保留四位有效数字);若KMnO4标准溶液久置释放出O2而变质,会导致测量结果__(填“偏高”、“偏低”或“无影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实中,不能用勒夏特列原理解释的是
①Fe(SCN)3溶液中加入固体KSCN后颜色变深②向稀盐酸中加入少量蒸馏水,盐酸中氢离子浓度降低 ③实验室常用排饱和食盐水的方法收集氯气 ④棕红色NO2加压后颜色先变深后变浅 ⑤加入催化剂有利于合成氨的反应 ⑥由H2(g)、I2(g)和HI(g)组成的平衡体系加压后颜色变深 ⑦500℃时比室温更有利于合成氨的反应 ⑧将混合气体中的氨液化有利于合成氨反应
A. ①②⑥⑧B. ①③⑤⑦C. ②⑤⑥⑦D. ②③⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有1.92g铜投入一定量的浓硝酸中,铜完全溶解,生成的气体颜色越来越浅,共收集到标准状况下的气体672mL,将盛有该气体的容器倒扣在水中,通入标准状况下一定体积的氧气,恰好使气体完全溶于水中,则通入氧气的体积是( )
A. 168mL B. 224mL C. 504mL D. 336mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高炉炼铁过程中发生反应: ![]() Fe2O3(s)+CO(g)
Fe2O3(s)+CO(g)![]()
![]() Fe(s)+CO2(g),该反应在不同温度下的平衡常数见右表。下列说法正确的是( )
Fe(s)+CO2(g),该反应在不同温度下的平衡常数见右表。下列说法正确的是( )
温度T/℃ | 1000 | 1150 | 1300 |
平衡常数K | 4.0 | 3.7 | 3.5 |
A. 由表中数据可判断该反应:反应物的总能量<生成物的总能量
B. 1000℃下Fe2O3与CO反应,t min达到平衡时c(CO) =2×10-3 mol/L,则用CO2表示该反应的平均速率为2×10-3/t mol·L-1·min-1
C. 为了使该反应的K增大,可以在其他条件不变时,增大c(CO)
D. 其他条件不变时,增加Fe2O3的用量,不能有效降低炼铁尾气中CO的含量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeBr2是一种黄绿色固体,某学习小组制备并探究它的还原性。
I.制备FeBr2固体
实验室用如图所示装置制取溴化亚铁。其中A为CO2发生装置,D和d中均盛有液溴,E为外套电炉丝的不锈钢管,e是两个耐高温的瓷皿,其中盛有细铁粉。
实验开始时,先将干燥、纯净的CO2气流通入D中,再将铁粉加热至600-700℃,E管中铁粉开始反应。不断将d中液溴滴入温度为100-120℃的D中,经过一段时间的连续反应,在不锈钢管内产生黄绿色鳞片状溴化亚铁。
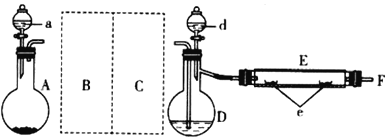
(1)若在A中盛固体CaCO3,a中盛有6mol/L的盐酸。为使导入D中的CO2为干燥纯净的气体,图中C处的洗气瓶中装有浓硫酸,则B中为___,若进入E装置中的CO2未干燥,则可能发生的副反应的化学方程式为___。
(2)E管中的反应开始前通入CO2的主要作用是___;E管中的反应开始后持续通入CO2的主要作用是___。
II.探究FeBr2的还原性
(3)现实验需要90mL0.2mol/LFeBr2溶液,取上述反应制得的FeBr2固体配制该溶液,所需仪器除烧杯、量筒、玻璃棒、胶头滴管外,还需要的玻璃仪器是___。
(4)已知:Cl2的CCl4溶液呈黄绿色,Br2的CCl4溶液呈橙红色。Cl2既能氧化Br-,也能氧化Fe2+。取10mL上述FeBr2溶液,向其中滴加几滴新制的氯水,振荡后溶液呈黄色。取少量反应后的溶液加入KSCN溶液,溶液变为血红色。另取少量反应后的溶液加入CCl4,振荡后,下层为无色液体。以上实验结论表明还原性:Fe2+___Br-(填“>”或“<”)。
(5)若向30mL步骤(3)的FeBr2溶液中通入标准状况下179.2mL的Cl2,取少量反应后的溶液加入CCl4,振荡后下层液体呈___色,写出该反应的离子方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表为周期表的一部分,其中的编号代表对应的元素。

请回答下列问题:
(1)表中属于d区的元素是________(填编号)。
(2)写出元素⑧的基态原子的电子排布式__________________________。
(3)某元素的特征电子排布式为nsnnpn+1,该元素原子的核外最外层电子的成对电子为________对。
(4)元素④的氢化物的分子构型为________,中心原子的杂化形式为________。
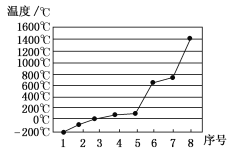
(5)第三周期8种元素按单质熔点高低的顺序如图,其中序号“8”代表________(填元素符号);其中电负性最大的是________(填图中的序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 使
使![]() 和
和![]() 通过灼热的炭层,生成HCl和
通过灼热的炭层,生成HCl和![]() ,当有
,当有![]() 参与反应时释放出145kJ热量,写出该反应的热化学方程式________________.
参与反应时释放出145kJ热量,写出该反应的热化学方程式________________.
![]() 火箭和导弹表面的薄层是耐高温物质
火箭和导弹表面的薄层是耐高温物质![]() 将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料
将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料![]() ,则反应过程中,每转移1mol电子放出的热量为____________.
,则反应过程中,每转移1mol电子放出的热量为____________.
![]() 甲胺
甲胺![]() 是合成太阳能敏化剂的原料。工业合成甲胺原理:
是合成太阳能敏化剂的原料。工业合成甲胺原理:![]()
![]()
![]() 。
。
![]() 已知键能指断开1mol气态键所吸收的能量或形成1mol气态键所释放的能量。几种化学键的键能如下表所示:
已知键能指断开1mol气态键所吸收的能量或形成1mol气态键所释放的能量。几种化学键的键能如下表所示:
化学键 |
|
|
|
|
|
键能 | 413 | 351 | 463 | 393 | 293 |
则该合成反应的![]() ______________。
______________。
若![]() 的活化能为
的活化能为![]() ,由此计算
,由此计算![]()
![]() 的活化能
的活化能![]() ______。
______。
![]() 用
用![]() 将HCl转化为
将HCl转化为![]() ,可提高效益,减少污染,传统上该转化通过如图所示的催化剂循环实现,
,可提高效益,减少污染,传统上该转化通过如图所示的催化剂循环实现,
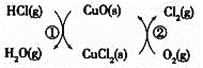
其中,反应![]() 为:
为:![]() 反应
反应![]() 生成
生成![]() 的反应热为
的反应热为![]() ,则总反应的热化学方程式为_____________,
,则总反应的热化学方程式为_____________,![]() 反应热用
反应热用![]() 和
和![]() 表示
表示![]() .
.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2CO(g)+O2(g)=2CO2(g) ΔH=-565.2 kJ·molˉ1,下列说法不正确的是
A.CO(g)+![]() O2(g)=CO2(g) ΔH=-282.6 kJ·molˉ1
O2(g)=CO2(g) ΔH=-282.6 kJ·molˉ1
B.2mol CO(g)与1mol O2(g)反应生成2mol CO2(s)放出热量小于565.2 kJ
C.相同条件下,2mol CO(g)和1mol O2(g)的总能量大于2mol CO2(g)的总能量
D.拆开2mol CO和1mol O2的化学键所需总能量低于形成2mol CO2化学键所放出总能量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com