
【题目】一定条件下2L的密闭容器中,有反应2SO2(g)+O2(g)![]() 2SO3(g)+Q。
2SO3(g)+Q。
(1)若起始时SO2为2mol,反应2min后SO2剩余1.6mol,则在0~2min内SO2的平均反应速率为_____mol/(L·min);若继续反应使SO2剩余1.2mol,则需要再反应的时间_____2min(不考虑温度变化);(选填“>”、“<”或“=”)
(2)反应达到平衡后,在其他条件不变的情况下,升高温度,下列说法正确的是_____;(选填字母)
A.正反应速率增大,逆反应速率减小,平衡向正反应方向移动
B.正反应速率减小,逆反应速率增大,平衡向逆反应方向移动
C.正、逆反应速率都增大,平衡向逆反应方向移动
D.正、逆反应速率都增大,平衡向正反应方向移动
(3)若反应速率(v)与时间(t)的关系如图所示,则导致t1时刻速率发生变化的原因可能是_____;(选填字母)

A.增大A的浓度 B.缩小容器体积
C.加入催化剂 D.降低温度
(4)在硫酸工业生产中,为了有利于SO2的转化,且能充分利用热能,采用了中间有热交换器的接触室(见图)。下列说法错误的是_____。(选填字母)
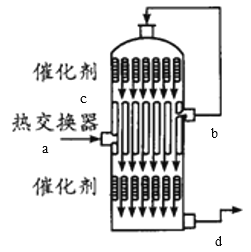
A.a、b两处的混合气体成分相同,b处气体温度高
B.c、d两处的混合气体成分不同
C.热交换器的作用是预热待反应的气体,冷却反应后的气体
D.反应气体进行两次催化氧化的目的是提高SO2的转化率
(5)硫酸工业制法中硫铁矿是制取SO2的主要原料。硫铁矿氧化焙烧的化学反应如下:3FeS2+8O2→Fe3O4+6SO2 4FeS2+11O2→2Fe2O3+8SO2,若48molFeS2完全反应耗用氧气131 mol,则反应产物中Fe3O4与Fe2O3物质的量之比为________。
【答案】0.1 > C B B 2:9
【解析】
(1) 根据反应速率的公式计算;
(2)升高温度正反应和逆反应速率都增大,又因为反应2SO2(g)+O2(g)![]() 2SO3(g)是放热反应,升高温度反应逆向移动;
2SO3(g)是放热反应,升高温度反应逆向移动;
(3)由图可知,t1时正反应和逆反应速率都增大,并且v(正)大于v(逆),说明反应正向移动。
(4) A.从a进入的气体是含有SO2、O2、N2等的冷气,经过热交换器后从b处出来的是热的气体;
B.在c处出来的气体SO2、O2在催化剂表面发生反应产生的含有SO3及未反应的SO2、O2等气体,该反应是放热反应,当经过热交换器后被冷的气体降温,SO3变为液态;
C.热交换器的作用是预热待反应的冷的气体,同时冷却反应产生的气体,为SO3的吸收创造条件;
D.使未反应的SO2进一步反应产生SO3,从而可以提高SO2的转化率;
(5)根据铁元素和氧元素守恒计算。
(1) 0~2min内SO2的平均反应速率为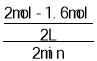 =0.1 mol/(L·min);反应过程中SO2的浓度降低,反应速率减慢,若继续反应使SO2剩余1.2mol,则需要再反应的时间>2min;
=0.1 mol/(L·min);反应过程中SO2的浓度降低,反应速率减慢,若继续反应使SO2剩余1.2mol,则需要再反应的时间>2min;
(2)升高温度正反应和逆反应速率都增大,又因为反应2SO2(g)+O2(g)![]() 2SO3(g)是放热反应,升高温度反应逆向移动,故选C;
2SO3(g)是放热反应,升高温度反应逆向移动,故选C;
(3)由图可知,t1时正反应和逆反应速率都增大,并且v(正)大于v(逆),说明反应正向移动,反应2SO2(g)+O2(g)![]() 2SO3(g)是气体体积减少的反应,可以通过缩小容器体积而增大压强实现,催化剂不改变反应进程,降低温度反应速率减小,故选B。
2SO3(g)是气体体积减少的反应,可以通过缩小容器体积而增大压强实现,催化剂不改变反应进程,降低温度反应速率减小,故选B。
(4) A.根据装置图可知,从a进入的气体是含有SO2、O2、N2等的冷气,经过热交换器后从b处出来的是热的气体,成分与a处相同,故A正确;
B.在c处出来的气体有SO2、O2和在催化剂表面发生反应产生的SO3,该反应是放热反应,经过热交换器时,把反应产生的热量传递给从a口进入的原料气,在下层催化剂处再次发生催化氧化,从d口出去的气体主要是生成的SO3及未反应的少量的SO2、O2等气体,故二者含有的气体的成分相同,故B错误;
C.热交换器的作用是预热待反应的冷的气体,同时冷却反应产生的气体,为SO3的吸收创造条件,故C正确;
D.处气体经过热交换器后再次被催化氧化,目的就是使未反应的SO2进一步反应产生SO3,从而可以提高SO2的转化率,故D正确;
故选:B。
(5)设反应产物中Fe3O4的物质的量为xmol,Fe2O3的物质的量为ymol,根据铁元素守恒有:3x+2y=48,根据消耗氧气的量有:8x+5.5y=131,解得:x=4mol,y=18mol,则则反应产物中Fe3O4与Fe2O3物质的量之比为2:9。


 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案科目:高中化学 来源: 题型:
【题目】某实验小组利用甲酸钠(HCOONa)制备Na2S2O4并测定产品的纯度,实验装置(夹持、加热仪器略)如图
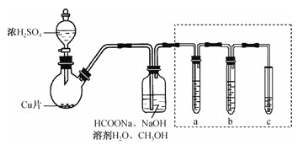
回答下列问题
(1)盛放浓硫酸的仪器名称为________,写出浓H2SO4与Cu反应的化学方程式 ________ 。
(2)SO2与HCOONa、NaOH反应生成Na2S2O4和CO2, 其离子方程式为________。
(3)图中虚线框中装置用于检验逸出气体中的CO2 , a、b、c所盛放的试剂依次为________、________、________。
(4)将反应液分离提纯得到Na2S2O4产品,取产品mg溶于水,并定容为100mL,取25.00mL加入锥形瓶中,加入NaOH溶液及指示剂,用cmol·mol-1的K3[Fe(CN)6]标准溶液进行滴定{4K3[Fe(CN)6]+2Na2S2O4+8NaOH=3K4[Fe(CN)6]+4Na2SO3+Na4[Fe(CN)6]+4H2O},滴定至终点时,消耗标准液VmL。则产品的纯度为________(写出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将1mLpH=2的一元酸HA溶液加水稀释至100mL,其pH与溶液体积(V)的关系如图所示,下列说法正确的是

A. 加热HA溶液时,溶液酸性增强
B. lmol/LHA溶液与1mol/LNaOH溶液等体积混合,若所得溶液中c(Na+)>c(A-),则2<a<4
C. 某浓度的NaA溶液的pH=d,则其中由水电离出的c(OH-)=1014-d
D. HA溶液与NaOH溶液恰好完全反应时,一定有c(Na+)>c(A-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe、Co、Ni均为第Ⅷ族元素,它们的化合物在生产生活中有着广泛的应用。
(1)基态Co原子的价电子排布式为____________
(2)已知HN3是一种弱酸,其在水溶液中的电离方程式为HN3![]() H++N3-,与N3-互为等电子体的一种分子为:_______,N3-离子杂化类型为___________。
H++N3-,与N3-互为等电子体的一种分子为:_______,N3-离子杂化类型为___________。
(3)Co3+的一种配离子[Co(N3)(NH3)5]2+中,Co3+ 的配位数是___________,1mol该配离子中所含σ键的数目为____,配位体NH3的空间构型为:___________ 。
(4)某蓝色晶体中,Fe2+、Fe3+分别占据立方体互不相邻的顶点,而立方体的每条棱上均有一个CN-,K+位于立方体的某恰当位置上。据此可知该晶体的化学式为____________,立方体中Fe2+间连接起来形成的空间构型是_____________。
(5)NiO的晶体结构如下图所示,其中离子坐标参数A为(0,0,0),B为(1,1,0),则C离子坐标参数为_______________。

(6)一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列,Ni2+填充其中(如下图),已知O2-的半径为a pm,每平方米面积上分散的该晶体的质量为__________g(用含a、NA的代数式表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(化学——选修5:有机化学基础)
高血脂是一种常见的心血管疾病,治疗高血脂的新药I的合成路线如下:
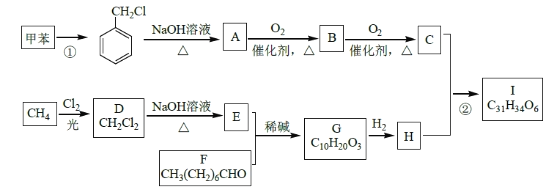

回答下列问题:
(1)反应①所需试剂、条件分别是____________;F 的化学名称为____________。
(2)②的反应类型是______________;A→B 的化学方程式为_____________________。
(3)G 的结构简式为______________;H 中所含官能团的名称是____________。
(4)化合物W的相对分子质量比化合物C大14,且满足下列条件,W的可能结构有___种。
①遇FeCl3 溶液显紫色 ②属于芳香族化合物 ③能发生银镜反应其中核磁共振氢谱显示有5 种不同化学环境的氢,峰面积比为2:2:2:1:1,写出符合要求的W 的结构简式____________。
(5)设计用甲苯和乙醛为原料制备![]() 的合成路线,其他无机试剂任选(合成路线常用的表示方式为:
的合成路线,其他无机试剂任选(合成路线常用的表示方式为:![]() )____________。
)____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸亚铁是黄色晶体,常用作照相显影剂、新型电池材料等。
实验室制备草酸亚铁并测定其中Fe2+和C2O42的物质的量之比确定其纯度,步骤如下:
Ⅰ.称取一定质量的硫酸亚铁铵[(NH4)2Fe(SO4)2]于烧杯中,加蒸馏水和稀硫酸,加热溶解,再加饱和H2C2O4溶液,加热沸腾数分钟,冷却、过滤、洗涤、晾干,得黄色晶体。
Ⅱ.称取m gⅠ中制得的晶体于锥形瓶中,加入过量稀硫酸使其溶解,70℃水浴加热,用c mol·L1 KMnO4溶液滴定至终点,消耗KMnO4溶液v1 mL(其中所含杂质与KMnO4不反应)。
Ⅲ.向Ⅱ滴定后的溶液中加入过量锌粉和稀硫酸,煮沸,至反应完全,过滤,用c mol·L1 KMnO4溶液滴定滤液至终点,消耗KMnO4溶液v2 mL。
Ⅳ.重复上述实验3次,计算。
已知:ⅰ.草酸是弱酸。
ⅱ.pH>4时,Fe2+易被O2氧化。
ⅲ.酸性条件下,KMnO4溶液的还原产物为近乎无色的Mn2+。
(1)Ⅰ中加入稀硫酸的目的是______、______。
(2)Ⅱ中与KMnO4溶液反应的微粒是______、______。
(3)Ⅲ中加入过量锌粉仅将Fe3+完全还原为Fe2+。若未除净过量锌粉,则消耗KMnO4溶液的体积V ______v2 mL(填“>”、“=”或“<”)。
(4)Ⅲ中,滴定时反应的离子方程式是______。
(5)m gⅠ中制得的晶体中,Fe2+和C2O42的物质的量之比是______(用含v1、 v2的计算式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,用蒸馏水稀释1 mol/L氨水至0.01 mol/L,随溶液的稀释,下列各项中始终保持增大趋势的是( )
A.![]() B.c(H+)·c(OH-)
B.c(H+)·c(OH-)
C.![]() D.c(OH-)
D.c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验操作和现象所得到的结论正确的是![]()
![]()
选项 | 实验操作 | 实验现象 | 结论 |
A | 向足量含KSCN的 | 溶液变黄 | 还原性:Fe2+>Br- |
B | 向2mL浓度为 | 开始出现白色沉淀,后出现黄色沉淀 |
|
C | 取等质量的Al和Fe,分别与足量的稀硫酸反应 | Al产生的氢气多 | 金属性: |
D | 向苯酚浊液中滴加饱和 | 浊液变澄清 | 酸性:苯酚 |
A.AB.B/span>C.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种元素X、Y、Z、W位于元素周期表的前四周期,已知它们的核电荷数依次增加,且核电荷数之和为51;Y原子的L层p轨道中有2个电子;Z与Y原子的价层电子数相同;W原子的L层电子数与最外层电子数之比为4∶1,其d轨道中的电子数与最外层电子数之比为5∶1。
(1)Y、Z可分别与X形成只含一个中心原子的共价化合物a、b,它们的分子式分别是________、________;杂化轨道分别是________、________;a分子的立体结构是________。
(2)Y的最高价氧化物和Z的最高价氧化物的晶体类型分别是________晶体、________晶体。
(3)Y与Z比较,电负性较大的是________,W2+离子的核外电子排布式是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com