
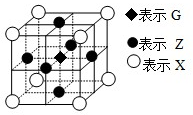
 已知:E、G、Q、R、T、X、Y、Z都是周期表中前四周期的元素,它们的核电荷数依次增大.E的简单阴离子最外层有2个电子,G原子最外层电子数是内层电子数的两倍,X元素最外层电子数与最内层电子数相同.T2R的晶体类型是离子晶体,Y原子基态3p原子轨道上有2个未成对电子,其单质晶体类型属于原子晶体;在元素周期表中Z元素位于第10列.
已知:E、G、Q、R、T、X、Y、Z都是周期表中前四周期的元素,它们的核电荷数依次增大.E的简单阴离子最外层有2个电子,G原子最外层电子数是内层电子数的两倍,X元素最外层电子数与最内层电子数相同.T2R的晶体类型是离子晶体,Y原子基态3p原子轨道上有2个未成对电子,其单质晶体类型属于原子晶体;在元素周期表中Z元素位于第10列. ,
, ;
;| ?? |
| O |
| ?? |
| O |
| ?? |
| O |
| ?? |
| O |
| 1 |
| 2 |
| 1 |
| 8 |


 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:
| A、纳米材料是指一种称为“纳米”的新物质制成的材料 |
| B、复合材料一般有强度高、质量轻、耐高温、耐腐蚀等优异性能,其综合性质超过了单 一材料 |
| C、光导纤维是以二氧化硅为主要原料制成的 |
| D、合成纤维的主要原料是石油、天然气、煤等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硫化亚铁溶于稀硝酸中:FeS+2H+═Fe2++H2S↑ |
| B、少量CO2通入硅酸钠溶液中:SiO32-+2CO2+2H2O═H2SiO3↓+2HCO3- |
| C、含等物质的量的KHCO3和Ba(OH)2溶液混合:HCO3-+Ba2++OH-═BaCO3↓+H2O |
| D、硫化钠水溶液呈碱性:S2-+2H2O?H2S+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
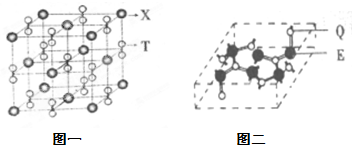 有E、Q、T、X、Z五种前四周期元素,原子序数E<Q<T<X<Z.E、Q、T三种元素的基态原子具有相同的能层和能级,且I1(E)<I1(T)<I1(Q),其中基态Q原子的2p轨道处于半充满状态,且QT2+与ET2互为等电子体.x为周期表前四周期中电负性最小的元素,Z的原子序数为28.
有E、Q、T、X、Z五种前四周期元素,原子序数E<Q<T<X<Z.E、Q、T三种元素的基态原子具有相同的能层和能级,且I1(E)<I1(T)<I1(Q),其中基态Q原子的2p轨道处于半充满状态,且QT2+与ET2互为等电子体.x为周期表前四周期中电负性最小的元素,Z的原子序数为28.查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | A | B | C |
| 性质结构信息 | 单质在氯气中燃烧火焰呈黄色并产生大量白烟,所得产物的阳离子与D的阳离子电子数相同. | 单质是带有金属光泽的灰黑色固体,是信息技术的关键材料. | 最高价氧化物的水化物与其气态氢化物反应得到离子化合物D. |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com