
【题目】铬、铁、镍、铜等金属及其化合物在工业上有重要用途。
(l)基态铬原子的价电子排布式为___________。
(2)CrO2C12和NaClO均可作化工生产的氧化剂或氯化剂。制备CrO2C12的反应为:
K2Cr2O7 + 3CCl4 = 2KCl+ 2 CrO2C12+ 3COCl2↑
① 上述反应式中非金属元素电负性由大到小的顺序是_______(用元素符号表示)。
② 常温下CrO2C12是一种易溶于CCl4的液体,则固态CrO2C12属于______晶体。
③ COCl2分子中所有原子均满足8电子结构,则COCl2分子中σ键和π键的个数比为_______。
(3)NiO、FeO的晶体结构均与氯化钠的晶体结构相同,其中Ni2+和Fe2+的半径分别为6.9×10-2 nm 和7.8×10-2 nm,则熔点:NiO______(填“< ”、“= ”或“>” ) FeO。
④CuCl的盐酸溶液能吸收CO生成复合物氯化羰基亚铜[Cu2Cl2(CO)2·2H2O] ,其结构如图所示。下列说法不正确的是_____(填字母序号)。

A.该复合物中只含有离子键和配位键 B.该复合物中Cl原子的杂化类型为sp3
C.该复合物中只有CO和H2O作为配位体 D.CO与N2的价电子总数相同,其结构为C≡O
【答案】 3d54s1 O>Cl>C 分子 3∶1 > AC
【解析】(1)基态铬原子的电子排布式为1s22s22p63s23p63d54s1,价电子排布式为3d54s1,故答案为:3d54s1;
(2)①反应式中非金属元素有三种:O、C、Cl,它们的电负性由大到小顺序是O>Cl>C,故答案为:O>Cl>C;
②常温时CrO2Cl2为液体,说明熔点低,所以固态CrO2Cl2属于分子晶体,故答案为:分子;
③COCl2分子中有1个C=O键和2个C-Cl键,所以COCl2分子中σ键的数目为3,π键的数目为1,个数比3:1,故答案为:3:1;
(3)NiO、FeO的晶体结构类型均与氯化钠的相同,说明二者都是离子晶体,离子晶体的熔点与离子键的强弱有关,离子所带电荷数越多,离子半径越小,离子键越强,熔点越高.由于Ni2+的离子半径小于Fe2+的离子半径,属于熔点是NiO>FeO,故答案为:>;
(4)A.该复合物中存在化学键类型有离子键、配位键、极性共价键等,故A错误;B.该复合物中Cl原子的杂化类型为sp3,故B正确;C.该复合物中配位体有CO、H2O和Cl原子,故C错误;D.CO与N2属于等电子体结构相似,故结构式为C≡O,故D正确;故选AC。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】已知甲烷的燃烧热为890.3 kJ·mol-1。氢气的燃烧热为285.8 kJ·mol-1。现有9 mol的甲烷和氢气的混合气体,完全燃烧后放出热量7408.2 kJ,则该混合气体中碳原子和氢原子的个数比
A. 1∶8B. 8∶1C. 4∶17D. 17∶4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)0.1 mol某烃在足量的氧气中完全燃烧,生成的CO2和水各0.6 mol,则该烃的分子式为 。
(2)若该烃不能使溴水或高锰酸钾溶液褪色,但在一定条件下,可以和液溴发生取代反应,其一溴取代物只有一种,则此烃属于 烃,结构简式为 ,名称是 ,该烃的二氯代物有 种。
(3)若该烃能使溴水褪色,且能在催化剂作用下与H2发生加成反应,生成2,2—二甲基丁烷,则此烃属于 烃,结构简式为 , 名称是 ;
核磁共振氢谱有 个吸收峰,其面积比是 。
下列物质中,与该烃互为同系物的是(填序号)_________,互为同分异构体的是________。
① CH3CH=CHCH3 ② CH2=CHC(CH3)3
③ CH3CH2CH=CHCH2CH3 ④(CH3)2CH(CH2)2CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下氯酸钾与浓盐酸反应放出氯气,现按下图进行卤素的性质实验。玻璃管内分别装有滴有不同溶液的白色棉球,反应一段时间后,对图中指定部分颜色描述正确的是( )
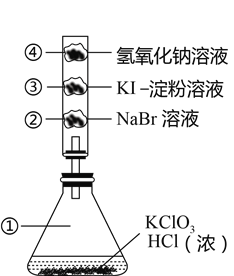
选项 | ① | ② | ③ | ④ |
A | 黄绿色 | 白色 | 紫色 | 白色 |
B | 黄绿色 | 橙色 | 紫色 | 黄绿色 |
C | 黄绿色 | 橙色 | 蓝色 | 白色 |
D | 黄绿色 | 橙色 | 蓝色 | 黄绿色 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E五种元素。其相关信息如下
元素 | 相关信息 |
A | A原子的1s 轨道上只有l 个电子 |
B | B是电负性最大的元素 |
C | C的基态原子2p轨道中有三个未成对电子 |
D | D是主族元素且与E同周期,其最外能层上有两个运动状态不同的电子 |
E | E能形成红色(或砖红色)的E2O和黑色的EO两种氧化物 |
请回答下列问题:
(1)写出E元素原子基态时的电子排布式__。
(2)C元素的第一电离能比氧元素的第一电离能_____(填“大”或“小”)。
(3)CA3分子中C原子的杂化轨道类型是__。
(4)A、C、E三种元素可形成[E(CA3)4]2+配离子,其中存在的化学键类型有_____(填序号)。
① 配位键 ② 金属键 ③ 极性共价键 ④非极性共价键 ⑤ 离子键 ⑥ 氢键
若[E(CA3)4]2+具有对称的空间构型,且当[E(CA3)4]2+中的两个CA3被两个Cl-取代时,能得到两种不同结构的产物,则[E(CA3)4]2+的空间构型为_______(填字母)
a.平面正方形 b.正四面体 c.三角锥形 d. V 形
(5)B与D可形成离子化合物,其晶胞结构如下图所示。其中D离子的配位数为____, 若该晶体的密度为ag/cm3,则B与D间最短距离是______cm (写出表达式即可)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用氟碳铈矿(主要成分CeCO3F)提取CeCl3的一种工艺流程如下:

请回答下列问题:
(1)CeCO3F中,Ce元素的化合价为_______。
(2)酸浸过程中用稀硫酸和H2O2替换HCl不会造成环境污染。写出稀硫酸、H2O2与CeO2反应的离子方程式:____________。
(3)向Ce(BF4)3为中加入KCl溶液的目的是_________。
(4)若溶液中的Ce3+沉淀完全,此时溶液的pH为_______(己知Ksp[Ce(OH)3]=1×10-20)
(5)加热CeCl3·6H2O和NH4Cl的固体混合物可得到无水CeCl3,其中NH4Cl的作用是________。
(6)准确称取0.7500g CeCl3样品置于锥形瓶中,加入适量过硫酸铵[(NH4)2S2O8]溶液将Ce3+氧取化为Ce4+,然后用0.1000mol/L(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗25.00mL标准溶液.(己知:Fe2++Ce4+= Ce3++Fe3+)
①已知:过二硫酸的结构式为![]() ,其中S元素的化合价为:______。 过硫酸铵[(NH4)2S2O8]溶液将Ce3+氧化为Ce4+的离子方程式为:_____________。
,其中S元素的化合价为:______。 过硫酸铵[(NH4)2S2O8]溶液将Ce3+氧化为Ce4+的离子方程式为:_____________。
②该样品中CeCl3的质量分数为____________。
③若使用久置的(NH4)2Fe(SO4)2标准溶液进行滴定,测得该CeCl3样品的质童分数将______ (填“偏大”、“偏小”或“无影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验原理、方法和结论都正确的是
A. 向饱和FeCl3溶液中滴加过量氨水,可制取Fe(OH)3胶体
B. 取少量溶液X,向其中加入适量新制氯水,再加几滴KSCN溶液,溶液变红,说明X溶液中一定含有Fe2+
C. 某钾盐溶于盐酸,产生能使澄清石灰水变浑浊的无色无味气体,说明该钾盐是![]()
D. 向久置的Na2SO3溶液中加入足量BaCl2溶液,出现白色沉淀;再加入足量稀盐酸,部分沉淀溶解,部分Na2SO3被氧化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com